��Ŀ����
����Ŀ��������β���к��е�CO���ò�������Ч������Դ�����ܷ��ο�����Ⱦ����ҵ�ϳ���CO��H2����Al��Zn��Cu��Ԫ���γɵĴ��������ºϳɼ״���
��1��ͼ1��ijͬѧ����CO��������ԭ�ӵĺ�������Ų�ͼ�� 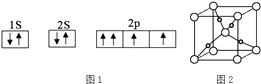
���жϸ��Ų�ͼ�����ȷ�������������������ж���ȷ���ÿղ��ûش𣩣�
��2��д��������CO��Ϊ�ȵ���������� ��
��3����CuSO4��Һ�м���������ˮ�ɵõ�����ɫ[Cu��NH3��4]SO4��Һ��[Cu��NH3��4]SO4�� ������λ����ͨ��������ӵ������µ��Ӷԣ����ܵ��Ӷ��γɣ�SO42���Ŀռ乹���� �� ��������N��O��S����Ԫ�صĵ�һ�����ܴ�С˳��Ϊ��������Ԫ�ط��ţ���
��4���״����������Է�������������ʶ��߷��Ӽ�������������»�������������Ƕ��߷е�IJ��ȴ�ܴ���ɸò����ԭ�������ڼ״�������̼ԭ�ӹ�����ӻ�����Ϊ ��
��5����ȩ������Cu��OH��2����Һ���ȿɵ�ש��ɫ����Cu2O����֪Cu2O�����Ľṹ��ͼ2��ʾ��
���ڸþ����У�Cu+����λ���� ��
�����þ����ı߳�Ϊa pm����Cu2O���ܶ�Ϊgcm��3��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA��
���𰸡�
��1������Υ������ԭ��
��2��CN����C22��
��3��N��Cu2+���������壻N��O��S
��4���״����Ӽ��������������е�Զ�������飻sp3
��5��2��![]()
���������⣺��1������������ԭ����ÿ��ԭ�ӹ�������ֻ������2������״̬�෴�ĵ��ӣ�����ͼ֪������һ���µ�����������ȫ��ͬ�ĵ��ӣ�����Υ������ԭ�������Դ��ǣ�����Υ������ԭ������2��ԭ�Ӹ�����ȡ��۵�������ȵ�����Ϊ�ȵ����壬CO�����к���2��ԭ�ӡ���۵�����Ϊ10��������CO��Ϊ�ȵ������������CN����C22�� �� ���Դ��ǣ�CN����C22������3��������к��йµ��ӶԵ�ԭ�Ӻͺ��пչ����ԭ��֮���γ���λ�������������Nԭ���ṩ�µ��Ӷԡ�Cu2+�ṩ�չ���������������Sԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӿռ乹��Ϊ�������壻
ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�ͬһ����Ԫ�أ����һ����������ԭ�������������С���������һ�����ܴ�С˳����N��O��S��
���Դ��ǣ�N��Cu2+���������壻N��O��S����4�����Ӽ�������������ʵ��۷е㣬�״����Ӽ����γ�������������֮�䲻���γ���������Լ״��۷е�������飻�״�������Cԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Cԭ���ӻ���ʽΪsp3 ��
���Դ��ǣ��״����Ӽ��������������е�Զ�������飻sp3����5���ٸþ�����С�������4���������=8�� ![]() +1=2�����ݻ�ѧʽ֪��С���ʾCuԭ�ӡ������ʾOԭ�ӣ�����ͼ֪��ÿ����ͭ��������2�������ӣ�������ͭ������λ����2�����Դ��ǣ�2��
+1=2�����ݻ�ѧʽ֪��С���ʾCuԭ�ӡ������ʾOԭ�ӣ�����ͼ֪��ÿ����ͭ��������2�������ӣ�������ͭ������λ����2�����Դ��ǣ�2��
�ھ������=��a��10��10cm��3 �� �����ܶ�= ![]() =
= 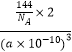 gcm��3=
gcm��3= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ� ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʯ����Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ�BaCl22H2O��������ͼ�� 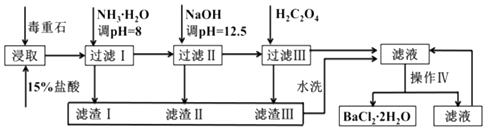
Ca2+ | Mg2+ | Fe3+ | |
��ʼ������pH | 11.9 | 9.1 | 1.9 |
��ȫ������pH | 13.9 | 11.1 | 3.2 |
��֪��Ksp��BaC2O4��=1.6��10��7 �� Ksp��CaC2O4��=2.3��10��9
��1��ʵ������37%����������1mol/L���ᣬ���������У�����Ҫʹ�õ���
a������ƿ b����Ͳ c���ձ� d���ζ���
Ϊ�˼ӿ춾��ʯ��������ʣ����Բ�ȡ�Ĵ�ʩ����������������
��2�����백ˮ������ҺpH=8��Ŀ���� �� �������к����ѧʽ��������H2C2O4ʱӦ���������ԭ���� ��
��3���������IJ����ǣ������ˣ�
��4�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������У�
��֪��2CrO42��+2H+=Cr2O72��+H2O��Ba2++CrO42��=BaCrO4��
�������ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ��������ΪV0mL��
�������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ���������ΪV1mL��ͨ�����㣬�Ȼ�����ҺŨ��ΪmolL��1���ú���ĸ��ʽ�ӱ�ʾ����