题目内容
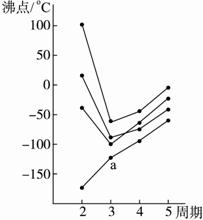
 下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,试完成下列问题:
下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,试完成下列问题:(1)a点表示的氢化物的分子式为
(2)d点表示的氢化物的分子式为
分析:在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,由沸点可知a应为H2O,c为CH4,d为SiH4,以此解答.
解答:解:(1)a的沸点为100℃,应为H2O,故答案为:H2O;
(2)第二周期元素形成的氢化物中只有CH4不存在氢键,影响该族元素的氢化物的沸点高低的主要因素是相对分子质量大小,相对分子质量越大,分子间作用力越强,则沸点越高,由图象可知c为CH4,d为SiH4,都为正四面体结构的非极性分子,
故答案为:SiH4;非极性;氢化物d的相对分子质量比氢化物c的大,分子间作用力强.
(2)第二周期元素形成的氢化物中只有CH4不存在氢键,影响该族元素的氢化物的沸点高低的主要因素是相对分子质量大小,相对分子质量越大,分子间作用力越强,则沸点越高,由图象可知c为CH4,d为SiH4,都为正四面体结构的非极性分子,
故答案为:SiH4;非极性;氢化物d的相对分子质量比氢化物c的大,分子间作用力强.
点评:本题考查同主族元素的性质的递变规律,侧重于氢键的考查,为高考高频考点,难度不大,注意把握氢键的特点,把握相关知识的学习与积累.

练习册系列答案
相关题目