题目内容
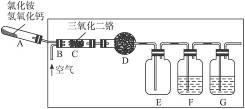
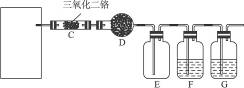
如下图所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:

(1)写出反应的化学方程式________
(2)B处的药品是________,作用是____________.
(3)若用下图所示装置收集氨气,气体由________口进入.

(4)氨是硝酸工业的重要原料.写出铜和稀硝酸反应的离子方程式________.
答案:
解析:
解析:
|
(1)2NH4Cl+Ca(OH)2 (2)碱石灰(1分) 干燥NH3(1分) (3)A(1分) (4)3Cu+8H++2NO3-=3Cu2++2NO+4H2O(2分) |

练习册系列答案
相关题目
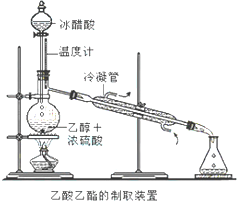 实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)