题目内容
 下列关于四个图象的说法正确的是( )
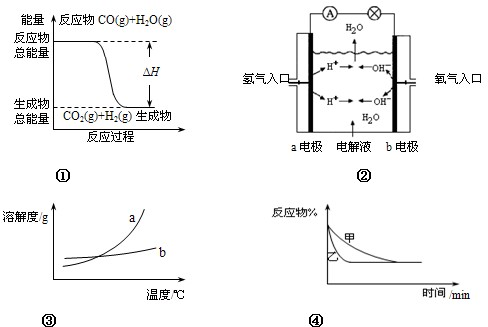
下列关于四个图象的说法正确的是( )分析:A、根据反应物的总能量和生成物的总能量的相对大小来判断该反应是吸热还是放热反应
B、根据氢氧燃料正、负极放电的物质来判断
C、根据溶解度随温度变化的规律来解决
D、根据先到达平衡的反应,压强大,在根据平衡移动原理,判断平衡是否移动
B、根据氢氧燃料正、负极放电的物质来判断
C、根据溶解度随温度变化的规律来解决
D、根据先到达平衡的反应,压强大,在根据平衡移动原理,判断平衡是否移动
解答:解、A、因反应物的总能量>生成物的总能量,根据能量守恒原理,该反应为放热,△H<0,故A错误;
B、因氢氧燃料电池的总反应:2H2+O2=2H2O,负极放电的物质为H2,正极放电的物质为O2,两者的物质的量之比为2,故B错误;
C、因物质a的溶解度随温度变化较大,而物质b的溶解度随温度变化不大,因此,可以用降温结晶方法从a、b混合物中析出物质a,故C正确;
D、因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,而图象中平衡未发生移动,乙应是加入催化剂的原因,故D错误;
故选:C.
B、因氢氧燃料电池的总反应:2H2+O2=2H2O,负极放电的物质为H2,正极放电的物质为O2,两者的物质的量之比为2,故B错误;
C、因物质a的溶解度随温度变化较大,而物质b的溶解度随温度变化不大,因此,可以用降温结晶方法从a、b混合物中析出物质a,故C正确;
D、因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,而图象中平衡未发生移动,乙应是加入催化剂的原因,故D错误;
故选:C.
点评:本题主要考查了化学反应类型(吸热还是放热)的判断,原电池正、负极的判断,溶解度随温度变化的规律的应用,压强对化学反应速率和平衡的影响.

练习册系列答案
相关题目