题目内容
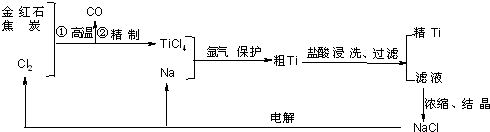
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4中精制TiCl4的方法是______ A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式______.
(3)写出电解熔融NaCl的化学方程式______;阴极产物是______.
(4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/°C | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
(2)写出金红石高温反应制取TiCl4的化学方程式______.
(3)写出电解熔融NaCl的化学方程式______;阴极产物是______.
(4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑
(1)粗TiCl4中加热易气化,与固体混合物可用分馏的方法分离,由表中数据可知,TiCl4在水中强烈水解,易变质,且易溶于乙醚中,不能分离,只能用蒸馏的方法分离,
故答案为:B;
(2)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
TiCl4+2CO,
故答案为:TiO2+2C+2Cl2
TiCl4+2CO;
(3)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
2Na+Cl2↑,在阴极发生还原反应生成钠,
故答案为:2NaCl (熔融)
2Na+Cl2↑;钠;
(4)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(5)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;2.
故答案为:B;
(2)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
| ||
故答案为:TiO2+2C+2Cl2
| ||
(3)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
| ||
故答案为:2NaCl (熔融)
| ||
(4)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(5)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;2.

练习册系列答案
相关题目
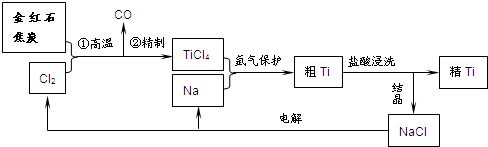
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4中精制TiCl4的方法是______ A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式______ TiCl4+2CO

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/°C | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
(2)写出金红石高温反应制取TiCl4的化学方程式______ TiCl4+2CO