题目内容
目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以能使Na+自由通过而导电的β-Al2O3陶瓷作固体电解质,电池反应为2Na+xS Na2Sx。回答下列问题:
Na2Sx。回答下列问题:
电池在工作时,正极反应式为 ;
负极反应式为 。
xS+2e-=Sx 2- 2Na-2e-=2Na+
解析

A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是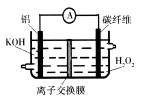
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H2O2+2 e一+2H+ =" 2" H2O |
| D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是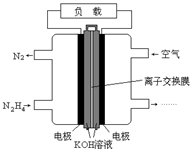
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料, 以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O=2Ag+Zn(OH)2。下列有关说法正确的是( )。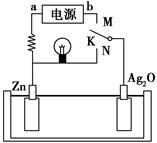
| A.放电时的负极反应和充电时的阴极反应属于可逆反应 |
| B.在电池放电过程中溶液的pH增大 |
| C.K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动 |
| D.K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
| A.电池工作时,MnO2失去电子 |
| B.电池工作时,电子由锌经外电路流向MnO2 |
| C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小 |
| D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应式为2H2+O2=2H2O,正极反应式为O2+2CO2+4e-=2CO32-,则下列推断正确的是( )
| A.负极反应式为H2+2OH--2e-=2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移电子的物质的量为2 mol |
| D.放电时负极有CO2生成 |
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电。镍氢电池的结构示意图如图所示。若电池总反应为:
Ni(OH)2 NiOOH+1/2H2,充电时阴极反应为:H2O+e-===1/2H2↑+OH-。则下列说法正确的是(双选) ( )。
NiOOH+1/2H2,充电时阴极反应为:H2O+e-===1/2H2↑+OH-。则下列说法正确的是(双选) ( )。
| A.充电时a极为正极 |
| B.放电时NiOOH发生氧化反应 |
| C.充电时,K+移向a极,OH-移向b极 |
| D.放电时正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH- |
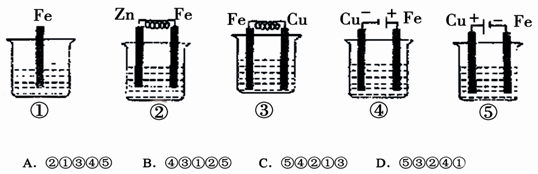
下列与装置有关的说法中正确的是( ) 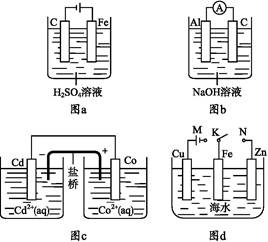
| A.图a中,随着电解的进行溶液中H+的浓度越来越大 |
B.图b中,Al电极作电池的负极,电极反应为Al-3e- Al3+ Al3+ |
C.图c中,发生的反应为Co+Cd2+ Cd+Co2+ Cd+Co2+ |
| D.图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀 |