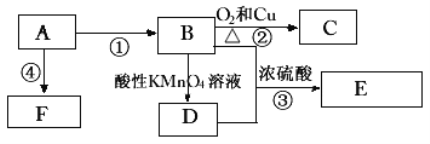
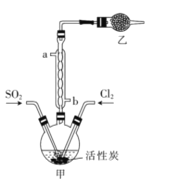
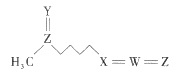题目内容
【题目】高铁电池是一种新型可充电电池,能较长时间保持稳定的放电电压。高铁电池放电时总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是______。
(2)放电时,正极发生________(填“氧化”或“还原”)反应。
(3)负极电极反应式为______________,正极电极反应式为______________正极附近溶液的碱性_____(填“增强,减弱,不变”)。
【答案】Zn 还原 Zn-2e-+2OH-=Zn(OH)2 ![]() +3e-+4H2O=Fe(OH)3+5OH- 增强
+3e-+4H2O=Fe(OH)3+5OH- 增强
【解析】
放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应;正极上得电子发生还原反应,总反应方程式减去负极电极反应式即得正极反应式。
(1)电池的负极上发生氧化反应,正极上发生还原反应。由高铁电池放电时总反应方程式可知,负极材料应为作还原剂的Zn,故答案为:锌;
(2)正极上得电子发生还原反应,故答案为:还原;
(3)负极电极反应式为Zn-2e-+2OH-═Zn(OH)2,由电池的总反应方程式-负极反应式=正极反应式可知,正极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,正极上生成氢氧根离子导致溶液中氢氧根离子浓度增大,溶液的碱性增强,故答案为:Zn-2e-+2OH-═Zn(OH)2;FeO42-+3e-+4H2O═Fe(OH)3+5OH-;增强。

练习册系列答案
相关题目