题目内容
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
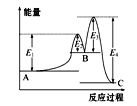
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的能量变化
D.整个反应中能量变化:ΔH=E1-E4
【答案】B
【解析】
试题分析:A.第一步的反应由于生成物的能量高于反应物,所以是吸热反应。而第二步的反应反应物的能量高于生成物,是放热反应,A错误;B.物质含有的能量越低,物质的稳定性就越强。在三种物质中由于C含有的能量最低,所以C的稳定性最强,B正确;C.加入催化剂会改变反应途径,降低反应的活化能,但是反应的焓变不变,C错误;D.整个反应的反应热是生成物与反应物含有的能量的差。根据图示可知ΔH=(E1+E3)-(E2+E4),D错误,答案选B。

练习册系列答案
相关题目

