题目内容
【题目】如图为一个装有活塞的密闭容器,内盛有22.4mL的NO,若通入11.2mL的O2(体积为标况下测得),保持温度,压强不变,则容器中的密度为( ) ![]()
A.等于1.369g/L
B.等于2.054g/L
C.于1.369g/L和2.054g/L之间
D.大于2.054g/L
【答案】D
【解析】解:一氧化氮与氧气恰好发生反应生成了二氧化氮,
2NO+ | O2 | ═ | 2NO2 |
2 | 1 | 2 | |
22.4mL | 11.2mL | 22.4mL |
反应后生成了22.4mL二氧化氮,假设二氧化氮体积不变,则容器中气体的密度为:ρ(NO2)= 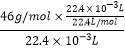 =2.054g/L,
=2.054g/L,
因存在转化平衡:2NO2 N2O4 , 混合气体的体积减小,
所以容器中气体ρ应大于2.054g/L,
故选D.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

练习册系列答案
相关题目