题目内容
下列叙述不正确的是( )
分析:A.金属性越强,对应最高价氧化物的碱性越强;
B.同主族元素从上到下金属性在增强;
C.具有相同电子排布的离子,原子序数大的离子半径小;
D.非金属性越强,则对应最高价氧化物的水化物的酸性越强.
B.同主族元素从上到下金属性在增强;
C.具有相同电子排布的离子,原子序数大的离子半径小;
D.非金属性越强,则对应最高价氧化物的水化物的酸性越强.
解答:解:A.因金属性K>Na>Mg,则NaOH的碱性介于KOH和Mg(OH)2之间,故A正确;
B.Li、Na、K、Rb元素都在ⅠA族,从上到下金属性在增强,故B正确;
C.Na+、Mg2+、Al3+的离子具有相同的电子排布,原子序数大的离子半径小,则Na+、Mg2+、Al3+的离子半径依次减小,故C错误;
D.非金属性Si<C<S,则H2SiO3、H2CO3、H2SO4酸性依次增强,故D正确;
故选C.
B.Li、Na、K、Rb元素都在ⅠA族,从上到下金属性在增强,故B正确;
C.Na+、Mg2+、Al3+的离子具有相同的电子排布,原子序数大的离子半径小,则Na+、Mg2+、Al3+的离子半径依次减小,故C错误;
D.非金属性Si<C<S,则H2SiO3、H2CO3、H2SO4酸性依次增强,故D正确;
故选C.
点评:本题考查元素周期表和元素周期律,明确同主族和同周期元素的性质变化规律是解答本题的关键,难度不大.

练习册系列答案
相关题目
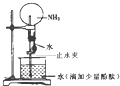 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |