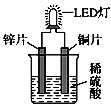
��Ŀ����
����Ŀ����һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������ӦX(g)��Y(g) ![]() 2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A. ��Ӧǰ2 min��ƽ��������(Z)=2.0��10��3 mol��L��1��min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)> ��(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D. �����������䣬�ٳ���0.2 molZ��ƽ��ʱX�������������
���𰸡�C
��������
���ݻ�ѧ��Ӧ���ʵļ��㹫ʽ���м��㡣�÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v�����������ڷ�Ӧǰ������������䣬�ʿ���ƽ��ʱ����ֵ����ʵ�������Ũ�ȼ��㻯ѧƽ�ⳣ������ͨ��0.2 mol Z���൱����ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ���X������������䡣
A��2min��Y���ʵ����仯Ϊ0.16mol-0.12mol=0.04mol����v��Y��=![]() 0.002mol/��Lmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Z��=2v��Y��=2��0.002mol/��Lmin��=0.004mol/��Lmin������A����
0.002mol/��Lmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Z��=2v��Y��=2��0.002mol/��Lmin��=0.004mol/��Lmin������A����
B���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v����������B����
C���ɱ������ݿ�֪7minʱ����Ӧ����ƽ�⣬ƽ��ʱY�����ʵ���Ϊ0.10mol����
X��g��+Y��g��2Z��g��
��ʼ��mol����0.16 0.16 0
�仯��mol����0.06 0.06 0.12
ƽ�⣨mol����0.1 0.1 0.12
���ڷ�Ӧǰ������������䣬�ʿ���ƽ��ʱ����ֵ����ʵ�������Ũ�ȼ��㻯ѧƽ�ⳣ�����ʻ�ѧƽ�ⳣ��K= ![]() =1.44����C��ȷ��
=1.44����C��ȷ��
D����ͨ��0.2 mol Z���൱����ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ���X������������䣬��D����
����ѡC��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���Ҫ����գ���Ԫ�ط��Ż�ѧʽ����
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | �� | |
4 | �� | �� | �� |
��1��д������Ԫ�ص�Ԫ�ط��ţ���_____��____��____
��2������ЩԪ���У�����õĽ���Ԫ����____������õķǽ���Ԫ����____������õ�Ԫ����____��
��3������ЩԪ�ص�����������Ӧˮ�����У�������ǿ����__________��������ǿ����___________�������Ե�����������____________��
��4�����������ĵ����У���ѧ���ʽϻ��õ���______���ж�������_______________��������� �ĵ����У���ѧ���ʽ�Ϊ���õ���______���ж�������_______________________��