题目内容
14.25℃时,下列各物质的水溶液的pH小于7的是( )| A. | Na2SO4 | B. | KOH | C. | Fe2(SO4)3 | D. | KHCO3 |
分析 25℃时,pH小于7溶液显示酸性,酸溶液或强酸弱碱盐的溶液,以及部分以电离为主的酸式盐的溶液都显酸性,据此分析.
解答 解:A、硫酸钠溶液中,硫酸钠为强酸强碱盐,pH等于7,故A错误;
B、氢氧化钾是强碱溶液,pH大于7,故B错误;
C、Fe2(SO4)3溶液中,三价铁离子水解,三价铁离子结合水电离的氢氧根,导致溶液显示酸性,pH小于7,故C正确;
D、KHCO3溶液中HCO3-的水解程度大于电离程度,以水解为主,溶液显碱性,溶液的pH>7,故D错误;
故选C.
点评 本题考查盐类的水解、人员酸碱性的分析判断,根据盐类水解的原理进行判断即可,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
4.下列说法正确的是( )
| A. | 温度高的物体内能不一定大,但分子平均动能一定大 | |
| B. | 当分子力表现为引力时,分子势能随分子间距离的减小而增大 | |
| C. | 外界对物体做功,物体内能一定增加 | |
| D. | 当分子间的距离增大时,分子力一定减小 |
5.下列物质中,既含离子键又含共价键的是( )
| A. | H2O | B. | NaOH | C. | H2 | D. | Na2O |
2.下列物质中,氯元素化合价最低的是( )
| A. | Cl2 | B. | HCl | C. | HClO | D. | KClO3 |
9.下列现象或事实可用同一原理解释的是( )
| A. | 二氧化硫和乙烯使溴水褪色 | |
| B. | 氯水和二氧化硫使品红溶液褪色 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | 亚硫酸钠和硫酸亚铁溶液长期暴露在空气中变质 |
6.下列物质属于天然高分子化合物的是( )
| A. | 蛋白质 | B. | 聚氯乙烯 | C. | 蔗糖 | D. | 油脂 |
3.由羟基与下列基团组成的化合物中,属于醇类的是( )
| A. | NH2- | B. |  | C. | 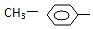 | D. | R-CO- |
5.下列说法正确的是( )
| A. | 25℃时,pH=2的硫酸与pH=12的Na0H溶液等体积混合溶液显酸性 | |
| B. | 20mL0.1mol/L二元弱酸H2A溶液与等体积,等浓度的NaOH溶液混合后,混合溶液中c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1mol/L | |
| C. | 向Na2CO3溶被中通入CO2至溶液为中性,则$\frac{{c(N{a^+})}}{{c(C{O_3}^{2-})}}$>1 | |
| D. | 常温下,向含0.lmolCH3COOH的溶液中加入amolNaOH 固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸的电离常数Ka=1.75×10-5) |


 .
.