题目内容
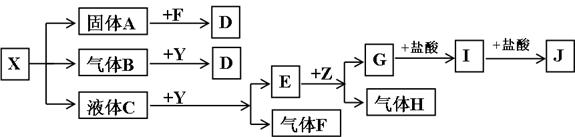
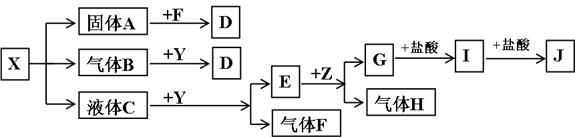
下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2∶1,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀。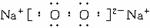
(1)写出X、E、I的化学式:X____________,E____________,I____________。
(2)写出Y的电子式________________________。
(3)关于Y的说法正确的是__________________。
A.Y是氧化物 B.Y是过氧化物
C.Y是含有非极性键的离子化合物 D.Y是碱性氧化物
(4)写出B和Y反应的化学方程式:____________________________________________。
(5)X和G的溶液能反应吗?如能反应,写出反应的离子方程式;如不能反应,请说明理由:____________________________________________________________________。
(1)X:NaHSO3 E:NaOH I:Al(OH)3
(2)![]()
(3)A、B、C
(4)Na2O2+SO2====Na2SO4
(5)![]() +
+![]() +H2O====
+H2O====![]() +Al(OH)3↓
+Al(OH)3↓
解析:焰色反应均为黄色的X、Y、A、D、E、G六种化合物均含Na+。G与盐酸反应生成的I又能与盐酸反应,可知I具有两性,结合I为白色沉淀,可知I为Al(OH)3,则G为NaAlO2,J为AlCl3。回忆反应“E(含Na+)![]() G(NaAlO2)+H(气体单质)”,可知Z为Al,H为H2,E为NaOH。据反应“液体C
G(NaAlO2)+H(气体单质)”,可知Z为Al,H为H2,E为NaOH。据反应“液体C![]() E(NaOH)+F(气体单质)”,可知F为O2,Y为Na2O2,C为H2O。据反应“X(含Na+)
E(NaOH)+F(气体单质)”,可知F为O2,Y为Na2O2,C为H2O。据反应“X(含Na+)![]() 固体A(含Na+)+气体B+液体C(H2O)”,可知X从NaHCO3、NaHSO3等物质中选择,再据固体A能与F(O2)反应,气体B能与Y(Na2O2)反应,可确定X为NaHSO3,A为Na2SO3,D为Na2SO4,B为SO2。(5)问,NaHSO3中
固体A(含Na+)+气体B+液体C(H2O)”,可知X从NaHCO3、NaHSO3等物质中选择,再据固体A能与F(O2)反应,气体B能与Y(Na2O2)反应,可确定X为NaHSO3,A为Na2SO3,D为Na2SO4,B为SO2。(5)问,NaHSO3中![]() 电离为主,
电离为主,![]()
![]() H++
H++![]() ,NaAlO2中
,NaAlO2中![]() 能水解,
能水解,![]() +2H2O
+2H2O![]() Al (OH)3+OH-,两平衡因相互促进而导致发生反应,离子方程式为
Al (OH)3+OH-,两平衡因相互促进而导致发生反应,离子方程式为![]() +
+![]() +H2O==== Al(OH)3↓+
+H2O==== Al(OH)3↓+![]() 。
。

 阅读快车系列答案
阅读快车系列答案