题目内容
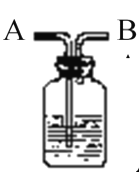
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
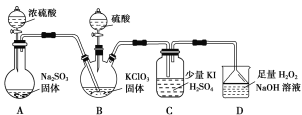
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
【答案】SO2+H2SO4+2KClO3=2KHSO4+2ClO2 通过检验I2的存在,证明ClO2有强氧化性 使ClO2尽可能多的与溶液反应,并防止倒吸 2.6 NaClO2 假设b正确, S2-的还原性强于I-,所以ClO2也能氧化S2-或ClO2是强氧化剂,S2-具有强还原性 SO42-+Ba2+=BaSO4↓
【解析】
浓硫酸和亚硫酸钠反应生成二氧化硫,A制备二氧化硫,B用于制备ClO2,同时还生成一种酸式盐,则B中发生反应SO2+H2SO4+2KClO3═2KHSO4+2ClO2,ClO2是一种黄绿色易溶于水的气体,具有强氧化性,所以C中发生氧化还原反应生成碘,注意防倒吸,装置C中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置D用于吸收尾气,反应生成NaClO2,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此解答。
(1)装置B用于制备ClO2,同时还生成一种酸式盐,根据元素守恒知,酸式盐为硫酸氢钠,该反应的化学方程式为SO2+H2SO4+2KClO3═2KHSO4+2ClO2;装置C中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯具有氧化性;
(2)ClO2是极易溶于水的气体,所以检验其强氧化性时导管靠近而不接触液面,以防倒吸;
(3)1molCl2即71g消毒时转移2mol电子,71gClO2消毒时转移电子为![]() ×(4+1)=5.2mol,其效果是同质量氯气的
×(4+1)=5.2mol,其效果是同质量氯气的![]() =2.6倍;
=2.6倍;
(4)装置D用于吸收尾气,H2O2作还原剂生成O2,H2O2O22e,生成1molO2转移电子2mol,则2molClO2得到2mol电子生成2molNaClO2;
(5)①由于ClO2具有强氧化性,Na2S具有强还原性,二者不可能不反应,所以假设a错误,假设b正确;
②ClO2氧化Na2S后溶液无明显现象,说明ClO2将S2氧化生成更高价的酸根SO42,所以可通过检验SO42的存在以证明ClO2与Na2S发生氧化还原反应,所用试剂为稀盐酸和BaCl2溶液,离子反应为:SO42+Ba2+═BaSO4↓。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。