��Ŀ����
����Ŀ�����Ȼ���(SO2Cl2)��һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ����Щ֧��װ��ʡ���ˣ���ʾ��
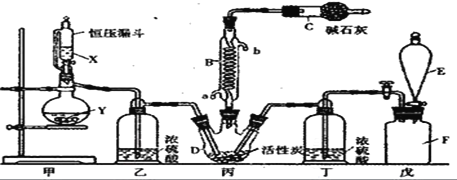
��֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69. 1�棻�����±Ƚ��ȶ��������ֽ⣬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������֮һΪ�Ȼ������塣
(1)E�е��Լ��DZ���ʳ��ˮ����������װ�ã� ��Fƿ�������ʵ�����Ʒ���_________���÷���ʽ��ʾ����
(2)B����Ӧ����ȴˮӦ��__________(�a����b��)�ӿ�ͨ�룻
(3)װ���ҺͶ���������____________��
(4)��ѹ©����������Ľṹ����ҪĿ����___________��
(5)д�����Ȼ���(SO2Cl2)ˮ�ⷴӦ�ķ���ʽ________________��
(6)SO2����ˮ���������ᣬ�����������ǿ�ڴ����ᣬѡ�������װ�ú�ҩƷ̽��������������������ǿ����

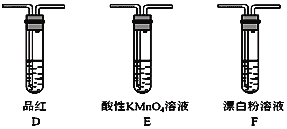
װ������˳��ΪA��_______��______��______��D��F��ͨ��________________����֤�������������ǿ�ڴ����ᡣ
���𰸡� MnO2+4HCl(Ũ) = MnCl2+Cl2��+2H2O��2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O a ����SO2�� Cl2����ֹSO2Cl2����ˮ�ⷴӦ ʹ���ӵ�Һ����˳��������ƿ�� SO2Cl2+H2O=H2SO4+2HCl C B E ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ����
�����������������(1)E�е��Լ��DZ���ʳ��ˮ��F������������ʵ�������ö���������Ũ���������ȡ������
(2)����ˮ�ͽ��߳���
(3) SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ��ͨ���װ�õ�������Ҫ���
(4)��ѹ©����ƽ��ѹǿ��ʹ���ӵ�Һ����˳��������ƿ�У�
(5)���Ȼ���(SO2Cl2)ˮ�����������������
(6)Ư�������������������Բ���ֱ�ӰѶ�������ͨ��Ư����Һ�У�Ҫ̽��������������������ǿ������Ҫ��֤���ԣ�������>̼��>��������
������ (1)E�е��Լ��DZ���ʳ��ˮ��F������������ʵ�������ö���������Ũ���������ȡ����������ʽΪMnO2+4HCl(Ũ) = MnCl2+Cl2��+2H2O��
(2)����ˮ�ͽ��߳�����ȴˮӦ��a�ӿ�ͨ�룻
(3) SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ��ͨ���װ�õ�������Ҫ����������װ���ҺͶ��������Ǹ���SO2�� Cl2����ֹSO2Cl2����ˮ�ⷴӦ��
(4)��ѹ©����ƽ��ѹǿ��ʹ���ӵ�Һ����˳��������ƿ�У�
(5)���Ȼ���(SO2Cl2)ˮ��������������ᣬˮ�ⷽ��ʽΪSO2Cl2+H2O=H2SO4+2HCl��
(6)Ư�������������������Բ���ֱ�ӰѶ�������ͨ��Ư����Һ�У�Ҫ̽��������������������ǿ������Ҫ��֤���ԣ�������>̼��>�����װ������˳��ΪA��C��ȥ���������е��Ȼ�����C��B�ö��������Ʊ�CO2��֤��������>̼�B��E�ø��������Һ��ȥCO2�е�SO2��E��D����SO2�Ƿ������D��F��ͨ����D��Ʒ�첻��ɫ��F�г��ְ�ɫ��������֤������̼��>�����ᣬ�Ӷ�֤�������������ǿ�ڴ�������

