题目内容
(6分)某学生为测定未知浓度的硫酸溶液,以0.1400mol/L的NaOH溶液滴定上述H2SO4,取待测硫酸25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)若使用甲基橙做指示剂,如何确定终点 (2)下列操作将导致测定值高于实际值的是
E.在滴定过程中不慎将数滴酸液滴在锥形瓶外
(3)计算待测硫酸溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
(1)若使用甲基橙做指示剂,如何确定终点 (2)下列操作将导致测定值高于实际值的是
| A.标准液在“0”刻度线以上,未予调整就开始滴定 |
| B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗 |
| C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视 |
| D.酸滴定管经蒸馏水洗净后,即注入锥形瓶进行中和滴定 |
(3)计算待测硫酸溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
溶液由红色突然变成黄色且半分钟不恢复原色;B 0.042mol/L
(1)甲基橙的变色范围为3.1~4.4,颜色变化为红、橙、黄,当向硫酸溶液中加入甲基橙,溶液颜色为红色,当加入氢氧化钠溶液时,溶液酸性减弱,溶液颜色由红色突然变成黄色且半分钟不恢复原色即达滴定终点;
(2)下列操作将导致测定值高于实际值的是:碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗,导致标准液浓度偏小,滴定硫酸时消耗体积增多,计算出的硫酸浓度偏高;
(3)根据酸碱中和反应的方程式可得,待测硫酸溶液的物质的量浓度为0.042mol/L
(2)下列操作将导致测定值高于实际值的是:碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗,导致标准液浓度偏小,滴定硫酸时消耗体积增多,计算出的硫酸浓度偏高;
(3)根据酸碱中和反应的方程式可得,待测硫酸溶液的物质的量浓度为0.042mol/L

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
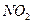 通入
通入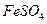 溶液中
溶液中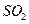 通入已酸化的
通入已酸化的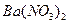 溶液中
溶液中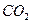 通入
通入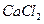 溶液中
溶液中
 低的是
低的是  酸溶解后未冷却就立即转
酸溶解后未冷却就立即转 移入容量瓶进行定容
移入容量瓶进行定容
 aOH的物质的量浓度为 。
aOH的物质的量浓度为 。