题目内容
下列说法错误的是
A、已知298K时,2SO2(g)+O2(g) 2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ
B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C、吸热反应是指反应物所具有的总能量低于生成物所具有的总能量,而不是看反应过程是否需要加热
D、对下列反应:HCl(aq) + NaOH(aq)=NaCl(aq) + H2O(l) △H=-Q1kJ/mol
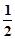 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= 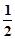 Na2SO4(aq)+H2O(l)
△H=-Q2kJ/mol
Na2SO4(aq)+H2O(l)
△H=-Q2kJ/mol
上述反应均在溶液中进行,则Q2>Q1
【答案】
A
【解析】

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
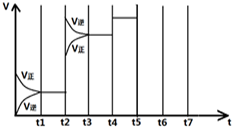 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示: CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率