题目内容
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
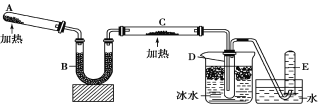
(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是______。
(2)B的作用是______。
(3)C中发生反应的化学方程式是:___,并在方程式中用单线桥标出电子转移的方向和数目___。
(4)D中收集到的物质是___,检验该物质的方法和现象是___;E中收集到的气体是_____(填化学式)。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2 除去氨气中的水蒸气 3CuO+2NH3
2NH3↑+2H2O+CaCl2 除去氨气中的水蒸气 3CuO+2NH3![]() 3Cu+N2+3H2O
3Cu+N2+3H2O 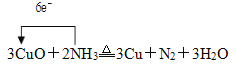 氨水 用红色石蕊试纸检验,试纸变蓝(或用酚酞溶液检验,酚酞溶液变红) N2
氨水 用红色石蕊试纸检验,试纸变蓝(或用酚酞溶液检验,酚酞溶液变红) N2
【解析】
A装置利用Ca(OH)2和NH4Cl混合加热制得氨气,经过B中碱石灰干燥后的氨气通入C中,将灼热的CuO还原为Cu,同时生成水和氮气,其中冰水中放置的D收集到氨水,E中收集的气体为氮气,据此分析解题。
(1) A中装有Ca(OH)2和NH4Cl混合粉末,混合加热生成氨气,则该反应的化学方程式是2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2;
2NH3↑+2H2O+CaCl2;
(2)装置B中盛装的碱石灰的作用是除去氨气中的水蒸气;
(3)C中氨气将灼热的CuO还原为Cu,同时生成水和氮气,发生反应的化学方程式是3CuO+2NH3![]() 3Cu+N2+3H2O,反应中NH3体现还原性,N元素的化合价从-3价升高为0价,每生成1个N2转移6e-,则用单线桥标出电子转移的方向和数目表示为
3Cu+N2+3H2O,反应中NH3体现还原性,N元素的化合价从-3价升高为0价,每生成1个N2转移6e-,则用单线桥标出电子转移的方向和数目表示为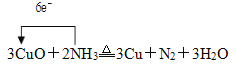 ;
;
(4) 冰水中放置的D收集的物质是氨水,氨水显碱性,则用红色石蕊试纸检验,试纸变蓝(或用酚酞溶液检验,酚酞溶液变红)即可说明是氨水;装置E收集到不溶于的气体为N2。

练习册系列答案
相关题目