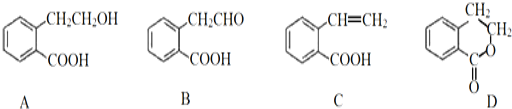
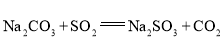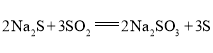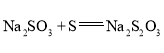题目内容
【题目】反应NH4Cl+NaNO2=NaCl + N2↑+2H2O放热且产生气体。下列表示反应中相关微粒的化学用语正确的是
A.中子数为12的钠原子:![]() B.N2的结构式: N=N
B.N2的结构式: N=N
C.O2-的结构示意图:![]() D.NaCl 的电子式:
D.NaCl 的电子式:![]()
【答案】D
【解析】
A. 核素的表达式![]() 中,A表示X原子的质量数,Z表示X原子的质子数,中子数=A-Z,则核电荷数为11,中子数为12的钠原子为:
中,A表示X原子的质量数,Z表示X原子的质子数,中子数=A-Z,则核电荷数为11,中子数为12的钠原子为:![]() ,故A错误;
,故A错误;
B. 氮原子最外层电子数为5,还需要3个电子(或形成3对共用电子对)达到8电子稳定结构,所以两个氮原子共用3对电子,氮气的结构式为N≡N,故B错误;
C. 氧原子的核电荷数为8,核外电子数为8,O2-是由O原子得到两个电子形成的,则O2-的核电荷数为8,核外电子数为10,故O2-的结构示意图: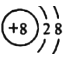 ,故C错误;
,故C错误;
D. NaCl为离子化合物,Na原子失去一个电子形成Na+,Cl原子得到一个电子形成Cl-,其电子式:![]() ,故D正确;
,故D正确;
故选D。

【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关
【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为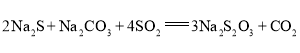 。回答下列问题:
。回答下列问题:
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
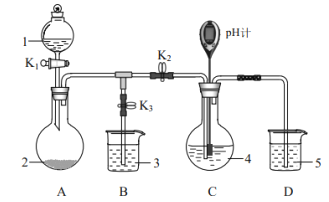
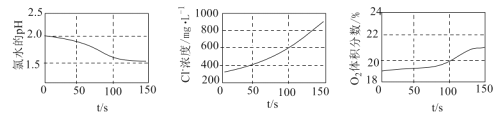
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。