��Ŀ����
����Ŀ��һ�����������������ȵ��������dz����Ĵ�����Ⱦ�Ȼ�������ڹ�ҵ�����Ź㷺����;��
��֪���������£�2NO��Na2O2===2NaNO2��
�����������£�NO��NO2��������MnO��Ӧ����NO3����Mn2������5NO2����2MnO4����6H��===5NO3����2Mn2����3H2O��
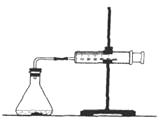
��.��ľ̿��Ũ���ᡢˮ��ͭΪԭ�����ɵ�һ��������������Ʒ�Ӧ�Ʊ��������Ƶ�װ������ͼ��ʾ��

(1)A�й۲쵽��������_________________________________��
(2)B�з�Ӧ�����ӷ���ʽ��____________________��_______________________��
(3)װ��C��������___________________��װ��F��������__________________��
(4)����װ��D����E�в�������������⣬���и�����________(�ѧʽ)��
��.ij�о���ѧϰС���NO2��Na2O2�ܷ�����Ӧ����̽����
��������裩
����һ��NO2��Na2O2����Ӧ��
�������NO2�ܱ�Na2O2������
��������______________________________________________��
�����ʵ�飩
(1)ʵ��ʱ����NO2����ͨ��ʢ��Na2O2�IJ������У�����ɫ��ĩ��ȫ��ɰ�ɫ��˵������________��������
(2)���������������Ӧ�Ļ�ѧ����ʽ��_______________________��
(3)Ϊ��֤������Ƿ��������С��ͬѧ�������¶���ʵ���о���������±����ݡ�
ʵ�鲽��(��Ҫ��д����������̣��Լ���������ѡ) | Ԥ�ڵ�ʵ�������� |
ȡ�����İ�ɫ���������Թ��У�������ˮ�ܽ⣬_________________________ | _______________________________ |
���𰸡� �к���ɫ�������� 3NO2��H2O===2H����2NO3����NO�� 3Cu��8H����2NO3��===3Cu2����2NO����4H2O ��ֹ���� ����δ��Ӧ��NO Na2CO3��NaOH NO2�ܱ�Na2O2��ԭ һ 2NO2��Na2O2===2NaNO3 �������10���ٵμ�ϡ�����ữ�����μӸ��������Һ �����������Һ����ɫ�������������������������Һ��ɫ��������������(����������Ҳ��)
����������1������������ľ̿��Ũ���ᷴӦ����CO2��NO2��ˮ������A�й۲쵽���������к���ɫ�������ɡ���2��������������ˮ���������NO���������ǿ�����ԣ��������ͭ��Ӧ����B�з�Ӧ�����ӷ���ʽ��3NO2��H2O��2H����2NO3����NO����3Cu��8H����2NO3����3Cu2����2NO����4H2O����3����������������ˮ������װ��C�������Ƿ�ֹ��������Ӧ��NO������NO�Ǵ�����Ⱦ���װ��F������������δ��Ӧ��NO����4����ʯ�ҵ�����������NO�е�ˮ�����Ͷ�����̼�����߾���������Ʒ�Ӧ����������װ��D����E�в�������������⣬���и�������Na2CO3��NaOH��
�������ڶ�������Ҳ���������ԣ��������Ӧ����NO2�ܱ�Na2O2��ԭ��
��1��ʵ��ʱ����NO2����ͨ��ʢ��Na2O2�IJ������У�����ɫ��ĩ��ȫ��ɰ�ɫ��˵�������˻�ѧ��Ӧ����˼���һ����������2������������������������������Ϊ�����ƣ���Ӧ�Ļ�ѧ����ʽ��2NO2��Na2O2��2NaNO3����3��Ҫ��֤������Ƿ������ֻ��Ҫ�����Ƿ�����������Ƽ��ɣ�����������������ɣ�����������ȷ�����������Ϣ��֪���������ʹ���Ը��������Һ��ɫ������ʵ�������ȡ�����İ�ɫ���������Թ��У�������ˮ�ܽ⣬�ٵμ�ϡ�����ữ�����μӸ��������Һ��������������Һ����ɫ��������������������������Һ��ɫ����������������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�