题目内容
(2分)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)==c(M+),而乙同学认为c(A-)与 c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为 同学的说法正确,理由是 。
甲;依溶液中的电荷守恒:c(M+)+c(H+)=c(A+)+c(OH-) ,因溶液呈中性则有:
 c(H+)=c(OH-) ,固有c(M+)=c(A+)
c(H+)=c(OH-) ,固有c(M+)=c(A+)
 c(H+)=c(OH-) ,固有c(M+)=c(A+)
c(H+)=c(OH-) ,固有c(M+)=c(A+)略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 用FeSO4等将+6价铬还原成+3价铬。
用FeSO4等将+6价铬还原成+3价铬。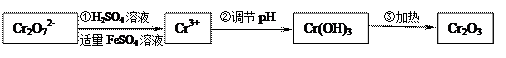
 ▲ 。
▲ 。 B.6~8 C.10~11 D.12~14
B.6~8 C.10~11 D.12~14 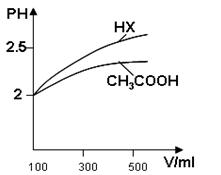
 l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为 。
l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为 。
 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示: 1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )