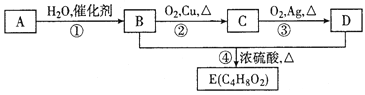
题目内容
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下: 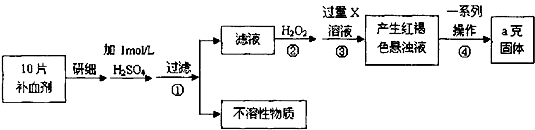
请回答下列问题:
(1)步骤②加入过量H2O2的目的: .
(2)步骤③中反应的离子方程式: .
(3)步骤④中一系列处理的操作步骤:过滤、、灼烧、冷却、称量.
(4)若实验无损耗,则每片补血剂含铁元素的质量g.
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O) ①上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硝酸
②滴定到终点时(恰好完全反应)的颜色为色.
【答案】
(1)将Fe2+全部氧化为Fe3+
(2)Fe3++3OH﹣=Fe(OH)3↓[或Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+]
(3)洗涤
(4)0.07a
(5)b;紫红
【解析】解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,
所以答案是:将Fe2+全部氧化为Fe3+;(2)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入的X可以是氢氧化钠溶液或氨水,反应方程式为Fe3++3OH﹣=Fe(OH)3↓[或Fe3++3NH3H2O=Fe(OH)3↓+3NH4+],
所以答案是:Fe3++3OH﹣=Fe(OH)3↓[或Fe3++3NH3H2O=Fe(OH)3↓+3NH4+];(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
所以答案是:洗涤;(4)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量 ![]() =0.07ag,
=0.07ag,
所以答案是:0.07a;(5)①高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,答案为:b;
②用KMnO4溶液滴定进行铁元素含量的测定,滴入最后一滴高锰酸钾溶液,溶液变为紫红色且半分钟不变化,说明反应达到终点,
所以答案是:紫红.