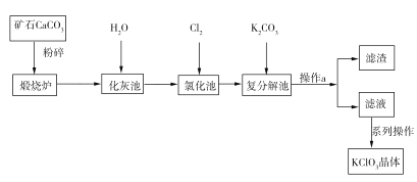
��Ŀ����
����Ŀ����֪�����������ݣ�7.2��10��4��4.6��10��4��4.9��10��10�ֱ��������йص�������ĵ��볣��������֪���з�Ӧ���Է�����
NaCN��HNO2===HCN��NaNO2
NaCN��HF===HCN��NaF
NaNO2��HF===HNO2��NaF
�ɴ˿��ж�������������ȷ���� (����)
A. K(HF)��7.2��10��4 B. K(HNO2)��4.6��10��4
C. ������������������Ӧ���ɵó����� D. K(HCN)<K(HNO2)<K(HF)
���𰸡�C
������������ǿ��������ĸ��ֽⷴӦԭ�����ɷ�ӦNaCN��HNO2=HCN��NaNO2�ó�����HNO2![]() HCN���ɷ�ӦNaCN��HF=HCN��NaF�ó�����HF
HCN���ɷ�ӦNaCN��HF=HCN��NaF�ó�����HF![]() HCN���ɷ�ӦNaNO2��HF=HNO2��NaF�ó�����HF
HCN���ɷ�ӦNaNO2��HF=HNO2��NaF�ó�����HF![]() HNO2��������HF
HNO2��������HF![]() HNO2
HNO2![]() HCN������Խǿ����ƽ�ⳣ��Խ����K(HCN)<K(HNO2)<K(HF)��K��HF��=7.2
HCN������Խǿ����ƽ�ⳣ��Խ����K(HCN)<K(HNO2)<K(HF)��K��HF��=7.2![]() 10-4��K��HNO2��=4.6
10-4��K��HNO2��=4.6![]() 10-4��K��HCN��=4.9
10-4��K��HCN��=4.9![]() 10-10��A��B��D�����ȷ�����ݵ�1���͵�3����Ӧ���Եó����ۣ����ɵ�1���͵�2�����2���͵�3����Ӧ���ܵó����ۣ�C�����ѡC��
10-10��A��B��D�����ȷ�����ݵ�1���͵�3����Ӧ���Եó����ۣ����ɵ�1���͵�2�����2���͵�3����Ӧ���ܵó����ۣ�C�����ѡC��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ