题目内容
根据反应:2Ag+(aq)+Fe(s)═Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,设反应产生的气体全部放出,反应前后溶液体积变化忽略不计.下列有关叙述错误的是( )
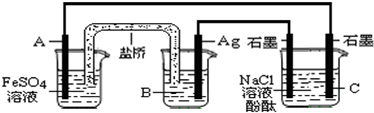

分析:原电池是由两个半电池组成的,根据电池反应式2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)可以判断出:负极是Fe作材料,发生的反应为:Fe-2e-=Fe2+,正极是Ag作材料,电解质溶液为
AgNO3溶液,发生的反应为:Ag++e-=Ag;电解NaCl溶液时,阳极的反应为:2Cl--2e-═Cl2↑,阴极的反应为:2H++2e-═H2↑,或为2H2O+2e-═H2↑+2OH-,当析出Ag21.6g时,Ag的物质的量为0.2mol,NaCl溶液的c(OH-)═1mol/L,故溶液的PH为14,是反应前的2倍.
AgNO3溶液,发生的反应为:Ag++e-=Ag;电解NaCl溶液时,阳极的反应为:2Cl--2e-═Cl2↑,阴极的反应为:2H++2e-═H2↑,或为2H2O+2e-═H2↑+2OH-,当析出Ag21.6g时,Ag的物质的量为0.2mol,NaCl溶液的c(OH-)═1mol/L,故溶液的PH为14,是反应前的2倍.
解答:解:A、正极是Ag作材料,则电极A用铁作负极,电解质溶液为AgNO3溶液,电解NaCl溶液时,C是电解池的阴极,发生的反应为2H++2e-═H2↑,或为2H2O+2e-═H2↑+2OH-,加入酚酞变红,故A正确;
B.原电池中,A极是原电池的负极,发生的反应为:Fe-2e-=Fe2+,正极是Ag作材料,电解质溶液为AgNO3溶液,发生的反应为:Ag++e-=Ag,故B正确;
C.当析出Ag21.6g时,n(Ag)═
mol═0.2mol,转移电子0.2mol,根据2H2O+2e-═H2↑+2OH-,可以判断出生成n(OH-)═0.2mol,则c(OH-)═
═1mol/L,故溶液的PH═14,是反应前的2倍.故C正确;
D.A极是原电池的负极,发生氧化反应,C极是电解池的阴极,发生还原反应,故D错误;
故选D.
B.原电池中,A极是原电池的负极,发生的反应为:Fe-2e-=Fe2+,正极是Ag作材料,电解质溶液为AgNO3溶液,发生的反应为:Ag++e-=Ag,故B正确;
C.当析出Ag21.6g时,n(Ag)═
| 21.6 |
| 108 |
| 0.2mol |
| 0.2L |
D.A极是原电池的负极,发生氧化反应,C极是电解池的阴极,发生还原反应,故D错误;
故选D.
点评:本题考查原电池和电解池的工作原理,涉及到电极材料和电解质溶液的判断,电极反应式的书写以及电解的计算,做题时注意各电极转移电子数相等.

练习册系列答案
相关题目