题目内容
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH)3沉淀)
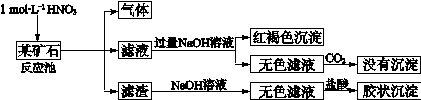
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 mol L-1 HNO3的体积为 L。

(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 mol L-1 HNO3的体积为 L。
(共13分)(1)2C+ SiO2 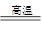 Si + 2CO↑ (2分) (2)ac(2分)
Si + 2CO↑ (2分) (2)ac(2分)
(3)SiO2+2OH- = SiO32-+H2O(2分) 无色溶液中通入CO2无白色沉淀生成(1分)
(4)3FeCO3+10H++NO3- = 3Fe3+ +3CO2↑+NO↑+5H2O(2分)
(5)NO循环使用能减少环境污染; NO跟H2O、O2反应后又得到硝酸提高原料利用率 (2分)
3.33×104(2分)
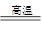 Si + 2CO↑ (2分) (2)ac(2分)
Si + 2CO↑ (2分) (2)ac(2分)(3)SiO2+2OH- = SiO32-+H2O(2分) 无色溶液中通入CO2无白色沉淀生成(1分)
(4)3FeCO3+10H++NO3- = 3Fe3+ +3CO2↑+NO↑+5H2O(2分)
(5)NO循环使用能减少环境污染; NO跟H2O、O2反应后又得到硝酸提高原料利用率 (2分)
3.33×104(2分)
试题分析:(1)碳在高温下还原二氧化硅即得到粗硅,所以用滤渣制备粗硅的化学反应方程式为2C+ SiO2
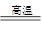 Si + 2CO↑。
Si + 2CO↑。(2)碳元素的非金属性强于硅元素的,则碳酸的酸性强于硅酸的,a正确;酸性越弱,相应的酸根越容易结合氢离子,则b不正确,结合质子的能力应该是> AlO2-CO>HCO3-。非金属性越强,氢化物的稳定性越强,c正确;核外电子排布相同的微粒,微粒半径随原子序数的增大而减小,则d不正确,离子半径应该是O2->Al3+,因此答案选ac。
(3)滤渣中含有二氧化硅,所以滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O。如果含有氧化铝,则滤液中含有偏铝酸钠。偏铝酸钠能和CO2反应生成白色沉淀氢氧化铝,据此可以判断,即无色溶液中通入CO2无白色沉淀生成。
(4)矿石中的碳酸亚铁能把硝酸氧化,所以反应的离子方程式是3FeCO3+10H++NO3- =3Fe3++3CO2↑+NO↑+5H2O。
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸提高原料利用率。根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是
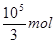 ,所以理论上至少需要1 mol L-1 HNO3的体积为L3.33×104。
,所以理论上至少需要1 mol L-1 HNO3的体积为L3.33×104。点评::该题是高考中的常见题型,难度较大,试题综合性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

练习册系列答案
相关题目

 2 NaOH+ H2↑
2 NaOH+ H2↑