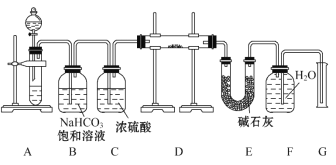
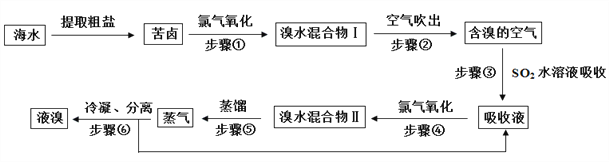
题目内容
【题目】已知一定质量的锌粒与稀盐酸反应(放热反应),生成H2的浓度与反应时间的关系如图所示,下列结论不正确的是( )
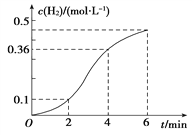
A. 若将锌粒改为锌粉,可以加快产生H2的反应速率
B. 反应前4 min内温度对反应速率的影响比浓度大
C. 反应前4 min内生成H2的平均速率v(H2)=0.09 mol·L-1·min-1
D. 反应开始2 min内平均反应速率最大
【答案】D
【解析】A. 若将锌粒改为锌粉,增大反应物的接触面积,可以加快产生H2的反应速率,A正确;B. 反应放热,因此反应前4 min内温度对反应速率的影响比浓度大,B正确;C. 反应前4 min内生成氢气浓度是0.36mol/L,因此生成H2的平均速率v(H2)=0.36mol/L÷4min=0.09 mol·L-1·min-1,C正确;D. 斜率越大,反应速率越快,则反应2~4min内平均反应速率最大,D错误,答案选D。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目