题目内容
亚氯酸盐是亚氯酸形成的盐类,含有亚氯酸根离子-ClO2-,其中氯的化合价为+3.已知以下一个制备亚氯酸盐的方法:又已知:每消耗1mol H2O2则生成2mol H2O和1mol O2.
请回答下列问题:
(1)请配平.
(2)指出:反应中的氧化剂是
(3)我国的科学家经过科学探索,发现将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内可制得ClO2和NaCl.请写出反应方程式:
(4)若生成8.96L O2(标准状况),则转移的电子的量为
分析:(1)根据O、Cl元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平;
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂;
(3)根据信息:氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内可制得ClO2和NaCl来书写方程式;
(4)根据方程式结合电子转移情况来判断即可.
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂;
(3)根据信息:氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内可制得ClO2和NaCl来书写方程式;
(4)根据方程式结合电子转移情况来判断即可.
解答:解:(1)在反应中,Cl元素化合价从+4价降为+3价,共得到1mol电子,O元素的化合价从-1价升高到了0价,一共失去2mol电子,根据电子守恒,所以Cl元素的物质们的前边系数是2,H2O2和O2的系数均是1,根据电荷守恒,氢氧根系数是2,水的系数是2,故答案为:2、1、2、2、1、2;
(2)Cl元素化合价降低,二氧化氯为氧化剂,O元素化合价升高,H2O2为还原剂,故答案为:二氧化氯;H2O2;
(3)根据信息:氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内可制得ClO2和NaCl,可以得到方程式为Cl2+2NaClO2=2ClO2+2NaCl,根据(1)得到制取NaClO2的方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,故答案为:Cl2+2NaClO2=2ClO2+2NaCl;2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O;
(4)若生成8.96L O2(标准状况),即氧气的物质的量是
=0.4mol,设生成8.96L O2(标准状况),转移电子物质的量为x,生成水的物质的量为y,
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 转移电子的物质的量
1 2 2
0.4mol y x
=
=
,解得x=0.8mol,y=0.8mol,所以生成水的质量是0.8mol×18g/mol=14.4g,故答案为:0.8mol;14.4g.
(2)Cl元素化合价降低,二氧化氯为氧化剂,O元素化合价升高,H2O2为还原剂,故答案为:二氧化氯;H2O2;
(3)根据信息:氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内可制得ClO2和NaCl,可以得到方程式为Cl2+2NaClO2=2ClO2+2NaCl,根据(1)得到制取NaClO2的方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,故答案为:Cl2+2NaClO2=2ClO2+2NaCl;2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O;
(4)若生成8.96L O2(标准状况),即氧气的物质的量是
| 8.96L |
| 22.4L/mol |
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 转移电子的物质的量
1 2 2
0.4mol y x
| 1 |
| 0.4mol |
| 2 |
| y |
| 2 |
| x |
点评:本题考查氧化还原反应,明确元素的化合价变化及原子守恒的方法来分析是解答本题的关键,并注意反应中化学计量数与转移电子数目的关系来解答即可.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
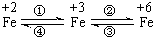 亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.
亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.