题目内容
18. (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是C
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是CA.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为H2+2OH--2e-=2H2O.
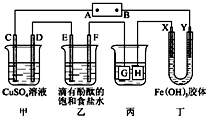
(3)电解原理在化学工业中有着广泛的应用.如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
①外接直流电源中A为正极,甲中电解时的化学反应方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,通过一段时间后向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为0.8mol.
②现用丙装置给铜件镀银,H为镀件(“镀件”还是“镀层”),当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为5.4g.
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)氢氧燃料碱性电池中,负极上氢气失去电子;
(3)①将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F即是阴极,并得到其他各个电极的名称,甲中电解时的化学反应方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电;
②电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的.
解答 解:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O,
故答案为:H2+2OH--2e-=2H2O;
(3)①将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;甲中电解时的化学反应方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,加入0.2molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.2mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.2mol时,则转移的电子是0.4mol,当电解掉0.2mol水时,转移电子是0.4mol,总共转移电子是0.8mol;
故答案为:正;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;0.8mol;
②电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,故答案为:镀件;5.4g.
点评 本题考查学生有关电解池的工作原理知识,综合性很强,难度中等,侧重于考查学生对基础知识的综合应用能力,要求学生熟记教材知识,学以致用.

 阅读快车系列答案
阅读快车系列答案| A. | 氯化钠晶体 | B. | 熔融状态的氯化镁 | ||
| C. | 氨水 | D. | 醋酸 |
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离; ②除去福尔马林中的乙酸,加入足量饱和碳酸钠溶液充分振荡蒸馏,收集馏出物 ③除去CO2中少量的SO2;气体通过盛有饱和碳酸钠溶液的洗气瓶; ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
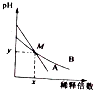 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
| A. | 原子数 | B. | 相对分子质量 | C. | 质量 | D. | 质子数 |
| A. | 常温常压下,11.2L CH4中含有的氢原子数为2NA | |
| B. | 11.2 L CO2与8.5 g NH3所含分子数相等 | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 常温下,1L 0.1mol/L MgCl2溶液中含Cl- 数为0.1NA |
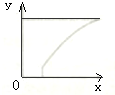 在恒容密闭容器中通入A,B两种气体,在一定条件下发生反应:2A(g)+B(g)?C(g)△H>0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
在恒容密闭容器中通入A,B两种气体,在一定条件下发生反应:2A(g)+B(g)?C(g)△H>0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )| x | y | |
| A | 通入A气体 | B的转化率 |
| B | 加入催化剂 | A的体积分数 |
| C | 增大压强 | 混合气体的总物质的量 |
| D | 升高温度 | 混合气体的总物质的量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NH4+ | B. | NH2- | C. | NH3 | D. | Na+ |