题目内容
11.一同学分析硫元素的化合价有-2、0、+4、+6,而硫单质处于中间价态,所以硫应该既有氧化性,又有还原性.该同学欲探究硫的还原性,下面是该同学的实验探究过程,请解答其中的问题.(1)该同学应该选择氧化剂(填“氧化剂”或“还原剂”)进行实验探究.
(2)该同学用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,反应的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
(3)该同学欲验证硫燃烧产物的性质,请你帮助他选择合适的试剂(填序号),并说明原因.
A.新制的氯水 B.品红溶液 C.滴有酚酞的NaOH稀溶液 D.H2S水溶液
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | ||
| 氧化性 | ||
| 还原性 | ||
| 酸性氧化物 |
分析 硫单质处于中间价态,所以硫应该既有氧化性,又有还原性,探究S的还原性,应选择S及氧化剂进行实验,氧化剂为氧气时,与S反应生化池二氧化硫;二氧化硫具有漂白性能使品红溶液褪色,二氧化硫具有氧化性可与还原剂硫化氢反应,具有还原性可与氯气反应,具有酸性氧化物的性质可与碱反应,以此来解答.
解答 解:(1)探究硫的还原性,则除S外,选择氧化剂进行实验,故答案为:氧化剂;
(2)用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,则S与氧气反应生成二氧化硫,反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(3)验证二氧化硫的漂白性,选择试剂为B,可观察到品红溶液褪色能说明;
验证二氧化硫的氧化剂,选择试剂为D,发生SO2+2H2S═3S↓+2H2O,观察到淡黄色沉淀生成可说明;
验证二氧化硫的还原性,选择试剂为A,发生SO2+Cl2+2H2O═H2SO4+2HCl,可观察到氯水颜色变浅,最后得到无色溶液能说明;
验证二氧化硫为酸性氧化性,选择试剂为C,发生SO2+2NaOH═Na2SO3+H2O,可观察到滴有酚酞的NaOH稀溶液由红色变为无色,可说明,
故答案为:
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | B | |
| 氧化性 | D | SO2+2H2S═3S↓+2H2O |
| 还原性 | A | SO2+Cl2+2H2O═H2SO4+2HCl |
| 酸性氧化物 | C | SO2+2NaOH═Na2SO3+H2O |
点评 本题考查性质实验方案的设计,为高频考点,把握元素的化合价与物质性质的关系,验证实验中试剂选择与发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
1.下列微粒中,与Ar原子具有相同的核外电子排布的微粒是( )
| A. | F- | B. | Mg2+ | C. | Cl- | D. | Na+ |
2.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | H2 |
| B | 胆矾 | 石灰水 | 硫酸钡 | H2CO3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 氯化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
19.如图表示取1mol乙烯雌酚进行的4个实验,下列对实验数据的预测正确的是( )
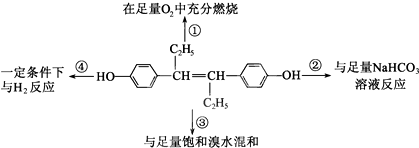

| A. | ①中生成7molH2O | B. | ②中生成2molCO2 | ||
| C. | ③最多消耗3molBr2 | D. | ④中最多消耗7molH2 |
16.如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程

已知:
请回答:
(1)下列物质中最适宜做氧化剂X的是B(填字母).
A.NaClO B.H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(3)操作①的名称是蒸发结晶.
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是C.
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是Fe+2Fe3+=3Fe2+(用离子方程式表示).

已知:
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
(1)下列物质中最适宜做氧化剂X的是B(填字母).
A.NaClO B.H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(3)操作①的名称是蒸发结晶.
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是C.
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是Fe+2Fe3+=3Fe2+(用离子方程式表示).
3.有一种气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是( )
| A. | 28.4 | B. | 71g•mol-1 | C. | 28.4g•mol-1 | D. | 71 |
20.关于氧化钠和过氧化钠的叙述,正确的是( )
| A. | 都属于碱性氧化物 | |
| B. | 溶于水后,所得水溶液的成分相同 | |
| C. | 都能和水发生化合反应 | |
| D. | 分别和二氧化碳反应都生成同一种盐 |
1.下列电离方程式书写正确的是( )
| A. | H2CO3?2H++CO32- | B. | CH3COOH=CH3COO+H+ | ||
| C. | FeCl3=Fe3++3Cl- | D. | NaHCO3=Na++H++CO32- |