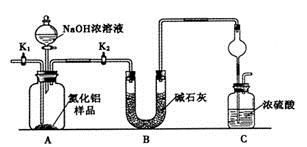
题目内容
(14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, | |
| | |

(1)将MnO2还原成Mn2+(2)Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O(3)既有MnCO3又有Mn(OH)2
①
②300℃以后,质量增加量为MnO氧化为MnO2 ,计算可得MnCO3质量为11.5(或MnO(OH)2的质量为10.5g),所以既有MnCO3又有Mn(OH)2。
①
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2。 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3。 |
试题分析:(l)在第②步中,将含有MnO2的固体与浓盐酸混合加热发生反应:MnO2+4H+ +2Cl-
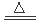 Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;(2)根据题意可知:在含有Mn2+离子的溶液中加入NH4HCO3溶液时发生的离子反应是Mn2++2HCO3- = MnCO3↓+ CO2↑+H2O;(2)①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3。为此证明固体是Mn(OH)2。②固体质量最小值是15.8g是MnO的质量,在300℃以后,质量增加量为MnO氧化为MnO2。增加的质量是17.4-15.8=1.6g.所以n(MnO)=1.6g÷16g/mol=0.1mol。在15.8g固体中含有MnO质量为0.1mol× 71g/mol =7.1g.含有MnO215.8g-7.1g=8.7g.及含有MnO20.1mol。由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2。所以在原固体中含有Mn(OH)20.1mol,质量是0.1mol ×105g/mol =10.5g;则原固体中含有MnCO3质量为22.0g-10. 5g=11.5g。所以原固体中既有MnCO3又有Mn(OH)2。
练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0