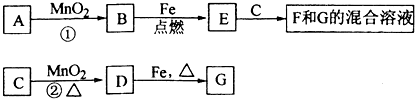
题目内容
13.下列关于平衡常数K的说法中,正确的是( )| A. | 在任何条件下,化学平衡常数是一个恒定值 | |
| B. | 平衡常数K只与温度有关,与反应浓度、压强无关 | |
| C. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| D. | 从平衡常数K的大小不能推断一个反应进行的程度 |
分析 化学平衡常数只受温度影响,与浓度、压强无关,平衡常数越大,反应进行的程度越大,可逆程度越小.
A、化学平衡常数受温度影响,温度变化,化学平衡常数发生变化;
B、平衡常数K只与温度有关,反应浓度、压强不影响化学平衡常数;
C、化学平衡常只与温度有关;
D、平衡常数越大,反应进行的程度越大,可逆程度越小.
解答 解:A、化学平衡常数受温度影响,温度变化,化学平衡常数发生变化,故A错误;
B、平衡常数K只与温度有关,反应浓度、压强不影响化学平衡常数,故B正确;
C、化学平衡常只与温度有关,浓度不影响化学平衡常数,故C错误;
D、平衡常数越大,反应进行的程度越大,可逆程度越小,平衡常数K的大小可以推断一个反应进行的程度,故D错误;
故选B.
点评 本题考查化学平衡常数的意义,平衡常数是表示反应进行程度的物理量,只与温度有关,题目较简单.

练习册系列答案
相关题目
3.可用于判断化学反应的自发与否的是( )
| A. | 仅用焓变 | B. | 仅用熵变 | C. | 仅用温度差 | D. | 用△H-T△S |
4.下列关于钠的叙述中正确的是( )
| A. | 将钠放在石棉网上加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| B. | 钠的熔点很高 | |
| C. | 钠是银白色金属,硬度很大 | |
| D. | 将钠投入硫酸铜溶液中,有气体产生,同时有红色的铜析出 |
1.实验室配制250mL 0.5mo1•L-1NaCl溶液,不需要用到的仪器是( )
| A. |  玻璃棒 | B. |  酒精灯 | C. |  胶头滴管 | D. |  容量瓶 |
5.下列反应不属于吸热反应的是( )
| A. | 锌放入稀硫酸中 | B. | 高锰酸钾分解 | ||
| C. | 氢气还原氧化铜 | D. | 碳和水蒸气在高温下反应 |
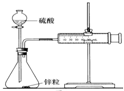 (1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作
(1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作