题目内容
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如图,先获得不溶性草酸氧钛钡晶体BaTiO(C2O4)2·4H2O,煅烧后可获得钛酸钡粉体。下列说法不正确的是( )
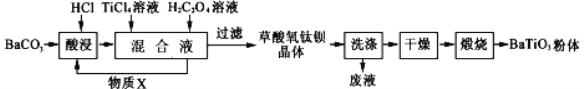
A. 酸浸时发生的反应的离子方程式为:BaCO3+2H+== CO2↑+Ba2++H2O
B. 加入H2C2O4溶液时,发生反应的化学方程式为:BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl
C. 可循环使用的物质X是CO2
D. 煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、CO2和H2O(g)
【答案】C
【解析】
由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)24H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,据此分析。
A. 碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,其离子方程式为:BaCO3+2H+== CO2↑+Ba2++H2O,A项正确;
B. 加入H2C2O4溶液生成草酸氧钛钡晶体,发生反应的化学方程式为:BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl,B项正确;
C. 加入H2C2O4溶液时发生反应BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl,生成的HCl可以在“酸浸”工艺中循环利用,C项错误;
D. BaTiO(C2O4)24H2O煅烧,发生分解反应,生成高温下的气体产物有CO、CO2、H2O(g),D项正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
【题目】(1)在氧化还原反应中,氧化剂__电子,发生的反应是__反应;还原剂__电子,发生的反应是__反应。铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
(2)0.6mol的氧气与0.4mol臭氧O3质量之比为___,分子个数之比为___,氧原子个数之比为___。
(3)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
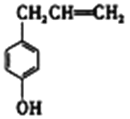
据此分析,将A和B相互分离的常用方法是:___。
(4)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A.B两组,而且每组中均含两种阳离子和两种阴离子。
A组:___;B组:____。