题目内容
【题目】某强氧化剂XO(OH)2+50mL2.4mol/L与30mL2mol/L的Na2SO3溶液恰好完全反应,则X还原后化合价为
A.+2B.+4C.0D.+6
【答案】B
【解析】
该反应中XO(OH)2+和Na2SO3发生氧化还原反应,Na2SO3被氧化为Na2SO4,S元素的化合价由+4价升高为+6价,则X的化合价降低,设元素X在还原产物中的化合价为x,由电子守恒可知,2mol/L×30mL×(6-4)=2.4mol/L×50mL×(5-x),解得x=+4,所以选项B正确。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】小麦的穗发芽影响其产量和品质。某地引种的红粒小麦的穗发芽率明显低于当地白粒小麦。为探究淀粉酶活性与穗发芽率的关系,进行了如下实验。
分组 步骤 | 红粒管 | 白粒管 | 对照管 | |
① | 加样 | 0.5mL提取液 | 0.5mL提取液 | C |
② | 加缓冲液(mL) | 1 | 1 | 1 |
③ | 加淀粉溶液(mL) | 1 | 1 | 1 |
④ | 37℃保温适当时间,终止酶促反应,冷却至常温,加适量碘液显色 | |||
显色结果 | + + + | + | + + + + + | |
(1)取穗发芽时间相同、质量相等的红、白粒小麦种子,分别加蒸馏水研磨、制成提取液(去淀粉),并在适宜条件下进行实验。实验分组、步骤及结果如下:
注:“+”数目越多表示蓝色越深
步骤①中加入的C是 ,步骤②中加缓冲液的目的是 。显色结果表明:淀粉酶活性较低的品种是 ;据此推测:淀粉酶活性越低,穗发芽率越 。若步骤③中的淀粉溶液浓度适当减小,为保持显色结果不变,则保温时间应 。
(2)小麦淀粉酶包括α-淀粉酶和β-淀粉酶,为进一步探究其活性在穗发芽率差异中的作用,设计了如下实验方案:
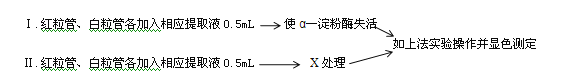
X处理的作用是使 。若Ⅰ中两管显色结果无明显差异,且Ⅱ中的显色结果为红粒管颜色显著 (填“深于”或“浅于”)白粒管,则表明α-淀粉酶活性是引起这两种小麦穗发芽率差异的主要原因。