题目内容
含有1.4 g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1.79 g,则该混合物中碱金属元素的质量分数为多少?
89%
若1.40 g全部为碱金属单质则由
2M+2H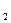 O = 2MOH+H
O = 2MOH+H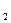

2M (M+17)
1.4 g m(MOH)
m(MOH)=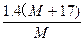 g=
g=
由于1.40 g为碱金属单质和氧化物组成的混和物
故有不等式:
解之得:24.3<M<61.03,显然该元素是钾
l.79 g KOH中含m(K)="1.79" g× ="l.25" g
="l.25" g
w(K)= 100%=89%
100%=89%
2M+2H
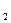 O = 2MOH+H
O = 2MOH+H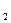

2M (M+17)
1.4 g m(MOH)
m(MOH)=
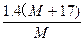 g=
g=
由于1.40 g为碱金属单质和氧化物组成的混和物
故有不等式:

解之得:24.3<M<61.03,显然该元素是钾
l.79 g KOH中含m(K)="1.79" g×
 ="l.25" g
="l.25" gw(K)=
 100%=89%
100%=89%
练习册系列答案
相关题目
 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。