题目内容
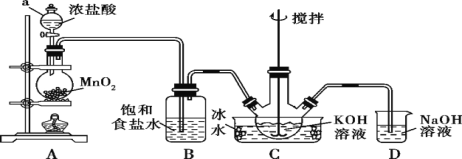
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(1)该流程中可以循环的物质是____。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式___。
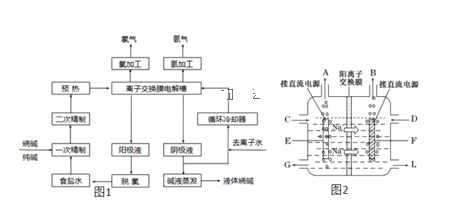
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是___,E电极的名称是___。电解总反应的离子方程式为____。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为___。
【答案】氯化钠、氢氧化钠 Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓ H2 阳极 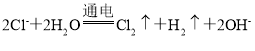 Na2SO3+Cl2+H2O=Na2SO4+2HCl 93.46%
Na2SO3+Cl2+H2O=Na2SO4+2HCl 93.46%
【解析】
(1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液写出离子方程式;
(3)电解池中,阳离子移向阴极,根据钠离子移动方向确定阴阳极,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算。
(1)根据工艺流程图结中用到的原料以及产物,可以知道氯化钠、氢氧化钠是可以循环使用的;
答案:氯化钠、氢氧化钠;
(2)除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液,离子方程式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为: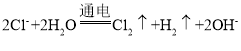 ,B处产生氢气;
,B处产生氢气;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,m(NaOH)=1.516×105kg×32%=4.85×104kg,则理论上需要电流量为![]() =3.252×107,则实际上耗电量为1.45×104×8×300=3.48×107,该电解槽的电解效率为
=3.252×107,则实际上耗电量为1.45×104×8×300=3.48×107,该电解槽的电解效率为![]() ×100%=93.46%。
×100%=93.46%。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】(1)800℃时,某密闭容器中存在如下反应:2NO2(g) ![]() 2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
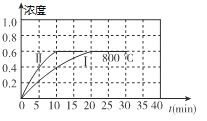
①反应Ⅱ相对于反应I而言,改变的条件可能是_______________.
②800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.5mol/L NO2,则v正____________v逆(填“<”、“>”或“=”)
(2)己知N2O4(g) ![]() 2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表__________(填化学式)的浓度,该反应的平衡常数K=_____________。
②前10min内用NO2浓度变化表示的反应速率为___________,20min时改变的条件是_____________;重新达到平衡时,NO2的质量分数___________________。
a.增大 b.减小
c.不变 d.无法判断