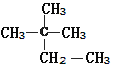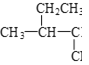题目内容
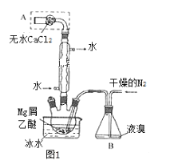
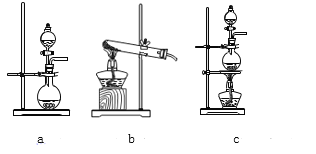
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。(B中装的是无水硫酸铜)
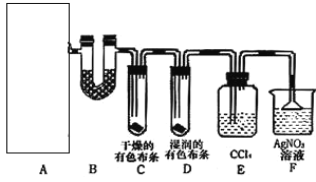
(1)A是氯气发生装置,实验室制取Cl2的原理是_____(用离子方程式表示)
(2)该实验中A部分的装置是_____(填字母)
(3)若用含有0.2molHCl的浓盐酸与足量的氧化剂反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是(填序号)_____
A.浓盐酸的浓度随着反应的进行变稀以后,将不再反应
B.加热时浓盐酸因挥发而损失
C.氧化剂不足
(4)装置E的作用是______。
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。该装置中应放入_______试剂。
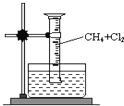
(6)用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
①该反应的反应类型为_________;
②该反应的化学方程式为________;(只写第一步)
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O c AB 吸收氯气 湿润的淀粉KI试纸(或湿润的有色布条) 取代反应 CH4+Cl2
Mn2++Cl2↑+2H2O c AB 吸收氯气 湿润的淀粉KI试纸(或湿润的有色布条) 取代反应 CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
【解析】
本题以氯气为载体,综合考查常见的基本实验操作、氯气的性质检验以及尾气处理等。注意紧扣实验目的“探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质”解答。
(1)实验室制取氯气一般用二氧化锰氧化浓盐酸生成,方程式为MnO2+4HCl![]() MnCl2+Cl2↑+H2O,离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+H2O,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)该实验中A部分的装置是固液加热型,故答案选c;
(3)A.随着反应的进行盐酸的浓度会逐渐降低,而二氧化锰是不能氧化稀盐酸的,所以实际生成的氯气总是小于理论值,故A正确;
B.加热时浓盐酸因挥发而损失,还原剂减少,所以实际生成的氯气总是小于理论值,故B正确;
C.0.2molHCl的浓盐酸与足量的氧化剂反应,故C错误;
答案选AB;
(4)由于F是用来检验氯化氢的,而氯气也能和硝酸银反应产生白色沉淀,所以在通入硝酸银溶液之前要先除去氯气。利用氯气能溶解的有机溶剂中,装置E的作用是除去氯气;
(5)氯气能溶解在四氯化碳中,但无法确定是否完全被吸收。所以需要在E和F之间连接1个装置,用来检验氯气是否完全被除去。可利用氯气的氧化性,能把碘化钾氧化生成单质碘,而单质碘能和淀粉发生显色反应,使溶液显蓝色。所以试剂是湿润的淀粉KI试纸。也可以通过漂白性来检验,因此也可以选择湿润的有色布条;
(6)①甲烷和氯气发生反应,甲烷分子中的氢原子被氯原子取代,所以属于取代反应;
②甲烷与氯气在光照下发生取代反应,甲烷分子中的氢原子被氯气分子中的氯原子取代,生成一氯甲烷和氯化氢,该反应的化学方程式为CH4+Cl2![]() CH3Cl+HCl。
CH3Cl+HCl。