题目内容
硫酸和硝酸是中学阶段常见的强酸。根据二者与金属的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.33.6L B.22.4L C.20.16L D.6.72L
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子
方程式加以说明 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为下列数据中的 。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(1)①D(2分)
②铜片继续溶解,有无色气体生成(无色气体后变为红棕色)(2分)
3Cu + 8H+ + 2NO3- = 3Cu2++ 2NO↑ + 4H2O (2NO+O2=2NO2)(2分)
(2)NO2、NO(2分) B(2分)
解析:略

练习册系列答案
相关题目
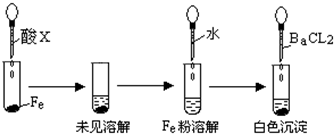

 (2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题: