题目内容
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示: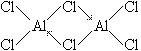
图中“Cl →Al”表示Cl原子提供了一对电子与Al原子共享。又,已知硼酸H3BO3为白色固体, 溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式:

答案:
解析:
提示:
解析:
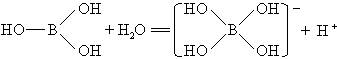
|
提示:
| 在气态氯化铝的分子结构中,由于铝原子和三个氯原子以共价单键结合,未达到8电子稳定结构,因此气态氯化铝分子以双聚形式存在。氯原子用其未成键的孤对电子,进入铝原子的空轨道,以配位键结合,形成双聚分子。
硼元素位于元素周期表第二周期、ⅢA,硼原子最外层有三个价电子,在形成最高正价氧化物对应水化物硼酸的结构中,硼原子分别和三个氢氧原子团以共价单键结合。常规分析硼酸的三个氢氧原子团分别电离出氢离子,表现三元酸的性质,但由于硼原子只形成三个共价单键,未形成8电子稳定结构。硼原子与铝原子有相似之处,可将上述信息迁移到硼酸中。当硼酸溶于水时,硼原子有空轨道,可以接受孤对电子,而水分子存在两对孤对电子,因此硼原子的空轨道吸引水分子中氧原子的孤对电子,与氧(氢氧根离子)结合,释放出氢离子。
|

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因.请写出下面这个方程式右端的两种离子的表达式.
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因.请写出下面这个方程式右端的两种离子的表达式.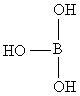 +H2O
+H2O
 H2O
H2O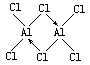
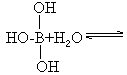 ______+______
______+______

