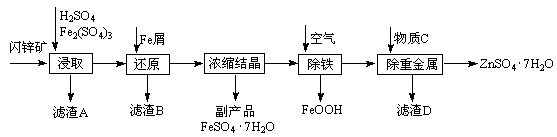
题目内容
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
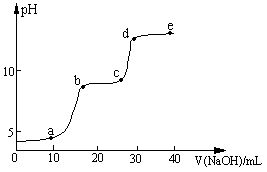
【实验】在0.1 mol?L-1 MgSO4、0.05 mol?L-1Al2(SO4)3的混合溶液中滴加0.5 mol?L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
【实验】在0.1 mol?L-1 MgSO4、0.05 mol?L-1Al2(SO4)3的混合溶液中滴加0.5 mol?L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。

(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
(1)碱式滴定管
(2)生成白色沉淀并逐渐增多
(3)生成Al(OH)3沉淀,消耗OH- Al(OH)3沉淀溶解,消耗OH-
Al3++3OH-=Al(OH)3↓ Al(OH)3比Mg(OH)2更难溶于水
(4)
(2)生成白色沉淀并逐渐增多
(3)生成Al(OH)3沉淀,消耗OH- Al(OH)3沉淀溶解,消耗OH-
Al3++3OH-=Al(OH)3↓ Al(OH)3比Mg(OH)2更难溶于水
(4)
| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
试题分析:由图像可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH- ; Al(OH)3沉淀溶解,消耗OH-三种可能,至于哪一阶段为那种可能,应与Al(OH)3、Mg(OH)2二者的溶解度有关。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目