题目内容
实验室欲配制6 mol·L-1的硫酸溶液,现有三种不同浓度的硫酸:①240 mL、1 mol·L-1的硫酸 ②150 mL 25%(ρ=1.18 g·cm-3)的硫酸 ③18 mol·L-1的H2SO4足量.还有三种规格的容量瓶:250 mL、500 mL、1000 mL.配制要求:①②两种H2SO4全部用完,不足部分由③补充.问需选用哪种容量瓶?需用18 mol·L-1浓H2SO4多少毫升?
答案:
解析:
解析:
|
答案:1 000 mL;295 mL 思路解析:①n1(H2SO4)=0.24 L×1 mol·L-1=0.24 mol ②n2(H2SO4)= n1(H2SO4)+n2(H2SO4)=0.24 mol+0.45 mol=0.69 mol 用250 mL容量瓶显然不行(①和②总体积已经超过250 mL) 若用500 mL容量瓶,则n3(H2SO4)=0.5 L×6 mol·L-1=3 mol 还需H2SO4:3 mol-0.69 mol=2.31 mol 需18 mol·L-1 H2SO4 V1= ①②和③总体积已经超过500 mL 故只能选用1 000 mL容量瓶,n4(H2SO4)=1 L×6 mol·L-1=6 mol 还需H2SO4:6 mol-0.69 mol=5.31 mol 需18 mol·L-1H2SO4 V2= |

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
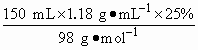 =0.45 mol
=0.45 mol