题目内容
已知:2Fe2++Br2====2Fe3++2Br-。请按要求写出下列各反应的离子方程式:(1)在FeBr2溶液中通入少量Cl2,离子方程式为_____________________。
(2)在FeBr2溶液中通入等物质的量的Cl2,其离子方程式为___________________________。
(3)在FeBr2溶液中通入过量的Cl2,其离子方程式为________________________________。
解析:这是涉及“量”的氧化还原反应的离子方程式的书写题,属于学科内的综合题,既要抓住离子方程式的书写要求,还要注意氧化还原反应的有关知识方能正确解题。
FeBr2在溶液中电离为两种都能被Cl2氧化的还原性离子Fe2+和Br-。但Cl2通入时,应先氧化还原性强的Fe2+,然后氧化Br-,这就涉及Cl2的用“量”问题了。(1)中Cl2少量,仅仅氧化了Fe2+。(3)中Cl2过量,将Fe2+、Br-氧化完全。(2)中Cl2既氧化了Fe2+又氧化了部分Br-。
答案:(1)2Fe2++Cl2====2Fe3++2Cl-
(2)2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
(3)2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-

练习册系列答案
相关题目
已知Br2+2Fe2+=2Fe3++2Br-,当向含1molFeBr2洛液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是( )
| A、反应前后溶液的颜色发生了改变 | B、反应后溶液中c(Cl-)=C(Br-) | C、参加反应的Cl2为1 mol | D、反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
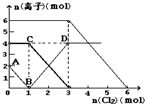 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( )
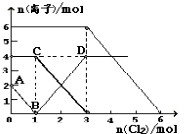 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )