��Ŀ����
����Ŀ���ں����ܱ�������ͨ��һ������X������Y���岢������Ӧ��2X��g��+Y��g�� 2Z��g����������¶�T1��T2��X�����ʵ���Ũ��c��x����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ�������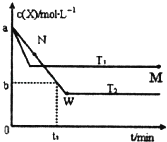
A.�÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B.T2�£���0t1ʱ���ڣ��ԣ�Y��= ![]() mol/��Lmin��
mol/��Lmin��
C.M���ƽ�ⳣ����W���ƽ�ⳣ��С
D.M��ʱ�ټ���һ������X��ƽ���X��ת��������
���𰸡�C
����������ͼ��֪���¶�ΪT1�ȵ���ƽ�⣬����T1��T2 �� �¶�Խ�ߣ�ƽ��ʱX�����ʵ���Ũ��Խ��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��A�����е�M��X��ת���ʽϵͣ����������Ƿ��ȷ�Ӧ�����Է�Ӧ���е�M��ų��������٣���A����B��T2�£���0��t1ʱ���ڣ�X��Ũ�ȱ仯Ϊ��c��X��=��a��b��mol/L����Y��Ũ�ȱ仯Ϊc��Y��= ![]() c��X��=
c��X��= ![]() mol/L������v��Y��=
mol/L������v��Y��= ![]() molL��1min��1 �� ��B����C���¶�Խ�߷�Ӧ����Խ����֪T1��T2 �� �¶�Խ��ƽ��������У�M���ƽ�ⳣ����W���ƽ�ⳣ��С����C��ȷ��D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�ƽ�����ƣ���X��ת���ʼ�С������M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С����D��������ѡC��
molL��1min��1 �� ��B����C���¶�Խ�߷�Ӧ����Խ����֪T1��T2 �� �¶�Խ��ƽ��������У�M���ƽ�ⳣ����W���ƽ�ⳣ��С����C��ȷ��D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�ƽ�����ƣ���X��ת���ʼ�С������M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С����D��������ѡC��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ���������Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����ܵó���ȷ�𰸣�

