题目内容
在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中, 是氧化剂; 是氧化产物;被还原的HNO3与参加反应的HNO3物质的量之比是 ;当有8mol HNO3被还原时,反应转移 个电子。
(1)HNO3 Cu(NO3)2 1:4 1.4448×1025
【解析】
试题分析:(1)在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,硝酸得电子作氧化剂,硝酸中N元素得电子被还原,铜 作还原剂,铜元素被氧化;如果有8mol硝酸参加反应,则有2mol硝酸参加氧化还原反应,所以被还原的HNO3与参加反应的HNO3物质的量之比是2:8=1:4,该反应中转移电子数=3(2-0)=2(5-2)=6;当有8mol HNO3被还原时,反应转移的电子数为:6×4×6.02×1023=1.4448×1025个。
考点:氧化还原反应

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下图1是工业上“碱法烟气脱硫法” 示意图,下图2是工业上“石灰→石膏烟气脱硫法”示意图,回答:
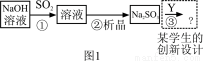
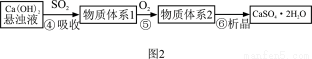
已知:
试 剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(1)图1中,反应①的离子方程式为 ,之一是 。
(2)图2中,反应⑤的目的是稳定固化硫元素形成高价态的化合物,氧气的作用是 。该法的优点之一是 。
(3)“碱法烟气脱硫法”中的产物Na2SO3的稳定性不好,易使硫元素重新转化为挥发性污染物,为避免之,设计了③的反应,写出其化学方程式为 。