��Ŀ����
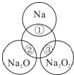 ��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ����
��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ����
- A.Na2O2������������Ŀ֮��Ϊ1��1
- B.��Ӧ�ٵ����ӷ���ʽΪ��Na+2H2O=Na++2OH-+H2��
- C.��Ӧ������ܲ���0.05mol O2
- D.�١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣��ڣ���
C
������A�����������е��������ǹ��������Ӳ��������ӣ����ݻ�ѧʽ�ж��������Ӹ���֮�ȣ�
B�����ӷ���ʽҪ��ѭ��ԭ���غ�͵���غ�ȡ����ɣ�
C�����ݹ������ƺ�ˮ��Ӧ�ķ���ʽ�����������������ʵ�����
D�����ݹ�������ʵ���������Һ�����ʵ���������Һ����������������������ʽ�ж�����������Դ�С��
���A��������������������O2 2-����������������Ŀ֮��Ϊ1��2����A����
B����Ӧ�ٵ����ӷ���ʽΪ��2Na+2H2O=2Na++2OH-+H2������B����
C����Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
2mol 1mol
0.1mol 0.05mol
���ݷ���ʽ֪��������0.05mol O2����C��ȷ��
D���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+ H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+ O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�
������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������ơ��ֱ�����ˮ������Һ�����������ֱ�Ϊ�� ��
��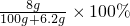 ��
��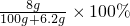 �����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=�ۣ���D����
�����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=�ۣ���D����
��ѡC��
���������⿼�����Ƽ��仯��������ʣ��״�ѡ����A��ע������������������ǹ��������Ӳ��������ӣ���Ϊ�״��㣮
������A�����������е��������ǹ��������Ӳ��������ӣ����ݻ�ѧʽ�ж��������Ӹ���֮�ȣ�
B�����ӷ���ʽҪ��ѭ��ԭ���غ�͵���غ�ȡ����ɣ�
C�����ݹ������ƺ�ˮ��Ӧ�ķ���ʽ�����������������ʵ�����
D�����ݹ�������ʵ���������Һ�����ʵ���������Һ����������������������ʽ�ж�����������Դ�С��
���A��������������������O2 2-����������������Ŀ֮��Ϊ1��2����A����
B����Ӧ�ٵ����ӷ���ʽΪ��2Na+2H2O=2Na++2OH-+H2������B����
C����Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
2mol 1mol
0.1mol 0.05mol
���ݷ���ʽ֪��������0.05mol O2����C��ȷ��
D���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+
 H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+
 O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�
������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������ơ��ֱ�����ˮ������Һ�����������ֱ�Ϊ��
 ��
��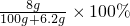 ��
��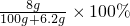 �����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=�ۣ���D����
�����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=�ۣ���D������ѡC��
���������⿼�����Ƽ��仯��������ʣ��״�ѡ����A��ע������������������ǹ��������Ӳ��������ӣ���Ϊ�״��㣮

��ϰ��ϵ�д�
 ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
�����Ŀ
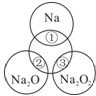 ��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����֮���ܷ�����Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����֮���ܷ�����Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������| A��ͼ��������ԲȦ�������������������� | B����Ӧ�ڵ����ӷ���ʽΪ��O2-+H2O=2OH- | C������Ӧ�١��۲����������ռ���ϲ���ȼ���Բ���ͼ��������ԲȦ������������0.05mol����۷�Ӧ�Ļ�ԭ����ΪO2 | D���١��ڳ�ַ�Ӧ��������Һ�������������ڣ��� |
��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ������������ķ�Ӧ����������������ԭ��Ӧ����ˮ�Ȳ���������Ҳ������ԭ�����ǣ� ��
| A���ס��� | B���ס��� | C���ҡ��� | D�������� |
 ��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
