题目内容
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)
ΔH = a kJ mol-1
2Fe(s)+3CO2(g)
ΔH = a kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

(1)-28.5 (2) 减小
减小
(3)①60% ②ac(漏选得1分,错选不得分)
(4)①bc(漏选得1分,错选不得分) ②锌
【解析】
试题分析:(1)根据盖斯定律可知∆H= ΔH1 -3ΔH2=-28.5kJ•mol‾1,所以a=-28.5 。
(2)因为Fe和Fe2O3为固体,所以平衡常数表达式为: ;因为该反应为放热反应,所以温度升高,平衡向左移动,K值减小。
;因为该反应为放热反应,所以温度升高,平衡向左移动,K值减小。
(3)①根据三段式进行计算:设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)
起始量(mol) 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K= =
=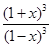 =64,计算得到x=0.6,则转化率=60%
=64,计算得到x=0.6,则转化率=60%
②a、反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,正确;b、乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率错误;c、甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3,正确;d、固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故d错误,故答案为:ac 。
(4)①装置中原电池的正极和电解池的阴极可以得到保护;bc可以保护铁;故答案为:bc。
②装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼可以选择锌。
考点:本题考查热化学方程式和盖斯定律计算应用,平衡常数计算应用,化学平衡三段式列式计算方法,原电池原理的分析判断。
