题目内容
2.某有色电解质溶液中,可能大量存在有Ag+、H+、Cu2+、OH-、Cl-离子,你认为:一定没有的离子是Ag+、OH-,不能确定的离子H+.分析 有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,以此来解答.
解答 解:有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,综上所述,一定含Cu2+、Cl-,一定不含Ag+、OH-,可能含H+,
故答案为:Ag+、OH-;H+.
点评 本题考查离子的推断知识,题目难度不大,注意离子推断中离子的共存及电中性原则.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
13.下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A. | MgCl2晶体、食盐溶液 | B. | Na2O、干冰 | ||
| C. | 熔融的KOH、液态汞 | D. | 醋酸、氨水 |
10.连二亚硫酸钠(Na2S2O4)是重要的化工原料,该物质在潮湿的空气中极不稳定,易分解并引起燃烧,反应的化学方程式为:2Na2S2O4═Na2S2O3+X+SO2↑.下列说法不正确的是( )
| A. | X的化学式为Na2SO4 | B. | SO2污染空气 | ||
| C. | Na2S2O3中S的化合价为+2 | D. | Na2S2O4要在干燥阴凉处密闭保存 |
14.在3个温度、容积相同的1L密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得一分钟后反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1]:
(1)由以上数据,甲、乙、丙达平衡时,N2的浓度大小关系为甲=乙<丙,从反应开始到达到平衡,甲中以H2表示的反应速率是0.75 mol/(L•min).
(2)该温度下,丙中反应2NH3?N2+3H2的平衡常数是34.17.
(3)a+b=92.4(填“<”、“>”或“=”,下同);α1+α3<1.
(4)若要使甲重新达平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,其他条件可采用BC.
A.使用催化剂 B.增大氮气浓度C.升高温度 D.缩小容器体积.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
(2)该温度下,丙中反应2NH3?N2+3H2的平衡常数是34.17.
(3)a+b=92.4(填“<”、“>”或“=”,下同);α1+α3<1.
(4)若要使甲重新达平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,其他条件可采用BC.
A.使用催化剂 B.增大氮气浓度C.升高温度 D.缩小容器体积.
11. 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )| A. | 镁和铝消耗硫酸的物质的量之比是2:3 | |
| B. | 参加反应的镁、铝的质量之比是8:9 | |
| C. | 反应中消耗的镁、铝的物质的量之比是3:2 | |
| D. | 反应中镁、铝转移电子的物质的量之比是2:3 |
11.硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.
(1)以N2和H2为原料合成氨气.反应:N2(g)+3H2(g)?2NH3(g)△H<0.
①该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
②该反应的化学平衡常数K与温度T的关系如表所示:
其中,K1>K2(填“>”、“=”或“<”).
③下列措施可以提高H2的转化率的是(填选项序号)bc.
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
④一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应.
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的$\frac{15}{16}$,求N2的转化率α1.(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2>α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0.该反应的反应速率(υ)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)abd.
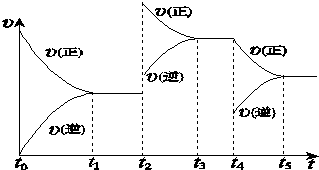
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol.
(1)以N2和H2为原料合成氨气.反应:N2(g)+3H2(g)?2NH3(g)△H<0.
①该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
②该反应的化学平衡常数K与温度T的关系如表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
③下列措施可以提高H2的转化率的是(填选项序号)bc.
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
④一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应.
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的$\frac{15}{16}$,求N2的转化率α1.(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2>α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0.该反应的反应速率(υ)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)abd.

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol.
 ;
;