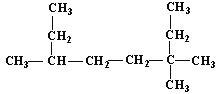题目内容
【题目】向 20mL 0.5mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是( )
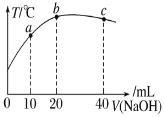
A.醋酸的电离平衡常数:b 点>a 点
B.由水电离出的 c(OH-):b 点>a 点
C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-)
D.b 点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】D
【解析】
酸碱中和反应是放热反应,所以酸碱中和过程中溶液温度升高,醋酸是弱电解质,在水溶液里存在电离平衡,溶液越稀醋酸的电离程度越大,醋酸电离过程吸热,温度越高,醋酸电离程度越大;酸或碱溶液抑制水电离,溶液含有弱根离子的盐促进水电离,结合电荷守恒来分析解答。
A.醋酸是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,醋酸的电离程度越大,其电离常数越大,因此醋酸的电离平衡常数:b 点>a 点,故A不符合题意;
B.b点酸碱恰好反应生成醋酸钠,醋酸钠促进水电离,c点氢氧化钠过量,氢氧化钠抑制水电离,所以由水电离出的c(OH):b点>c点,故B不符合题意;
C.如果溶液中c(CH3COO)=c(Na+),根据电荷守恒知,溶液中c(OH)=c(H+),醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使其溶液呈中性,则醋酸应该稍微过量,所以从a点到b点,混合溶液中可能存在:c(CH3COO)=c(Na+),故C不符合题意;
D.从b点到c点,氢氧化钠过量,溶液中的溶质是醋酸钠和氢氧化钠,当氢氧化钠的物质的量大于醋酸钠的物质的量时,混合溶液中存在:c(Na+)>c(OH)>c(CH3COO)>c(H+),故D符合题意;
故答案为:D。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |