题目内容
下列说法不正确的是
- A.将2.3g固体钠加入97.7g水中,所得溶液的质量分数大于4%
- B.将3.1g固体氧化钠加入96.9g水中,所得溶液的质量分数大于4%
- C.将3.9g固体过氧化钠加入96.1g水中,所得溶液的质量分数大于4%
- D.将4g三氧化硫加入96g水中,所得溶液的质量分数大于4%
B
分析:A、根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数;
B、根据溶液质量等于溶质的质量+溶剂的质量,然后根据计算公式再算出所得溶液的质量分数;
C、根据固体过氧化钠与水反应生成氢氧化钠的方程式算出反应后溶质氢氧化钠的质量,计算出溶液质量,根据计算公式再算出所得溶液的质量分数;
D、根据三氧化硫与水反应生成硫酸的方程式算出反应后溶质硫酸的质量,再计算出溶液质量,然后根据计算公式再算出所得溶液的质量分数.
解答:A、溶解后溶质是NaOH,2Na+2H2O═2NaOH+H2↑
46 80 2
2.3g 4g 0.1g
反应后所得溶液的质量分数: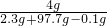 ×100%=
×100%= ×100%一定大于4%,故A正确;
×100%一定大于4%,故A正确;
B、溶解后溶质是NaOH,NaOH的质量分数=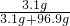 ×100%=3.1%,故B错误;
×100%=3.1%,故B错误;
C、溶解后溶质是NaOH,Na2O+H2O=2NaOH
62 40×2
3.1g 8g
NaOH的质量分数=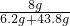 ×100%=16%,故C正确;
×100%=16%,故C正确;
D、溶解后溶质是硫酸,SO3+H2O=H2SO4
80 98
4g 4.9g
硫酸的质量分数=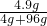 ×100%=4.9%,故D正确,
×100%=4.9%,故D正确,
故选B.
点评:本题主要考查了溶液的质量分数的计算,需要注意的是加入的物质不一定是溶质,要根据方程式算出溶质质量再进行计算.
分析:A、根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数;
B、根据溶液质量等于溶质的质量+溶剂的质量,然后根据计算公式再算出所得溶液的质量分数;
C、根据固体过氧化钠与水反应生成氢氧化钠的方程式算出反应后溶质氢氧化钠的质量,计算出溶液质量,根据计算公式再算出所得溶液的质量分数;
D、根据三氧化硫与水反应生成硫酸的方程式算出反应后溶质硫酸的质量,再计算出溶液质量,然后根据计算公式再算出所得溶液的质量分数.
解答:A、溶解后溶质是NaOH,2Na+2H2O═2NaOH+H2↑
46 80 2
2.3g 4g 0.1g
反应后所得溶液的质量分数:
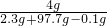 ×100%=
×100%= ×100%一定大于4%,故A正确;
×100%一定大于4%,故A正确;B、溶解后溶质是NaOH,NaOH的质量分数=
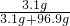 ×100%=3.1%,故B错误;
×100%=3.1%,故B错误;C、溶解后溶质是NaOH,Na2O+H2O=2NaOH
62 40×2
3.1g 8g
NaOH的质量分数=
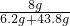 ×100%=16%,故C正确;
×100%=16%,故C正确;D、溶解后溶质是硫酸,SO3+H2O=H2SO4
80 98
4g 4.9g
硫酸的质量分数=
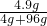 ×100%=4.9%,故D正确,
×100%=4.9%,故D正确,故选B.
点评:本题主要考查了溶液的质量分数的计算,需要注意的是加入的物质不一定是溶质,要根据方程式算出溶质质量再进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目







 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是