题目内容
【题目】近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 ![]() 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中含氧官能团的名称 、 。
(2)乳酸能与纯铁粉反应制备一种补铁药物
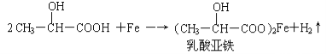 该反应中的还原剂是____________
该反应中的还原剂是____________
(3) 乳酸发生下列变化
![]()
所用的试剂是a ,b (写化学式)
(4)请写出下列反应的化学方程式,并注明反应类型:
①乳酸与乙醇的反应 ; 。
【答案】(1)羟基、羧基(不分先后,每空2分)
(2)Fe (2分)
(3)NaHCO3或NaOH 或Na2CO3(任一种即可)、 Na (每空各2分)
(4)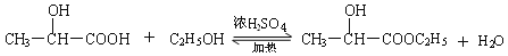
(2分)(反应条件不写扣1分) 、 酯化反应或取代反应(2分)
【解析】
试题分析:(1)根据乳酸的分子结构简式可知,在该物质的分子中含有羟基、羧基两种官能团;(2)乳酸具有酸性,可以与比较活泼的金属Fe发生之后反应产生乳酸亚铁和氢气,在该反应中Fe失去电子,被氧化产生Fe2+,所以还原剂是Fe,弱酸电离产生的H+获得电子变为氢气,乳酸是氧化剂。(3)在乳酸中加入的物质只与羧基反应,不能与羟基发生反应,则加入的物质a可以是NaOH 或NaHCO3或Na2CO3;反应产生的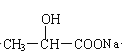 中的醇羟基再发生反应,则加入的物质是金属Na;(4)乳酸含有羧基,可以与乙醇发生酯化反应产生酯和水,脱水方式是酸脱羟基乙醇脱氢,则反应的方程式是:
中的醇羟基再发生反应,则加入的物质是金属Na;(4)乳酸含有羧基,可以与乙醇发生酯化反应产生酯和水,脱水方式是酸脱羟基乙醇脱氢,则反应的方程式是: 。该反应是酯化反应,也属于取代反应。
。该反应是酯化反应,也属于取代反应。

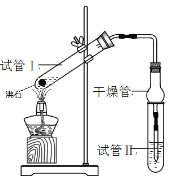
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。某学生在实验室利用下图的实验装置制备乙酸乙酯并研究其反应条件。
物质 | 沸点/C | 密度/gcm3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
① 配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
② 按图连接实验装置并检验气密性
③ 分别在试管1、试管2中加入反应液
④ 用酒精灯微热3min,再加热使之微微沸腾3min
⑤ 分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:______________(按着加入的先后顺序写出名称),乙醇过量的目的是:_______________;
(2)该反应的平衡常数表达式K=______________;
(3)试管Ⅱ中所盛试剂为___________,欲将其物质分离使用的仪器为___________,在充分振荡的过程中,发生的反应为________________;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和_________mol/L;
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是____________;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是_______________;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中_______的得到,那么产率会_____(“较高”或“偏低”);
