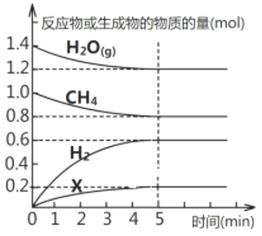
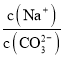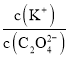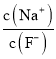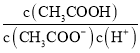题目内容
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图所示实验。
Ⅰ.实验探究
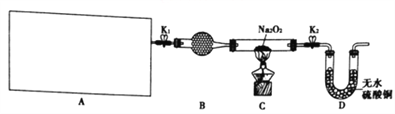
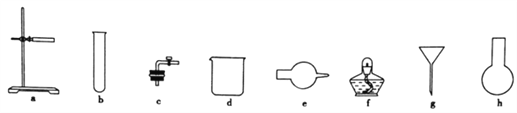
(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是_________。
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是_________,其作用是________。
(3)下面是实验过程中的重要操作,正确的顺序是_________(填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为___________________________________________________。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________,操作2的名称是_________。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________(填“偏 大” “偏小”或“不变”)。
【答案】 acde 碱石灰 吸收氢气中的水和氯化氢 CBAD Na2O2+H2![]() 2NaOH 玻璃棒 蒸发结晶 偏小
2NaOH 玻璃棒 蒸发结晶 偏小
【解析】(1)实验室可以用锌粒和稀硫酸(或稀盐酸)制取氢气,不需要加热,若从图示仪器中选择一部分组装成一套能随开随停的装置,则可以用e盛装锌粒、d盛装酸液、用a起固定作用、用c导气和开关,故选择的仪器编号是acde。
(2)装置A中用粗锌和稀盐酸制取氢气,则氢气中会混有水和氯化氢,因为Na2O2与水和氯化氢都能反应,可用碱石灰除去水和氯化氢,所以B装置中所盛放的试剂是碱石灰,其作用是吸收氢气中的水和氯化氢。
(3)实验开始应先通入氢气排出装置中的空气,以保证探究Na2O2与H2能否发生反应实验的准确性,确定氢气纯净后,加热Na2O2反应一段时间,停止加热充分冷却后再停止通入氢气,综上分析,正确的顺序是:CBAD。
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,则氢气与Na2O2发生了反应;无水硫酸铜未变蓝色,则反应没有生成水,根据原子守恒,Na2O2与H2反应的化学方程式为:Na2O2+H2![]() 2NaOH。
2NaOH。
(5)①由题意结合流程,操作2是从溶液中得到氯化钠晶体,故操作2名称为:蒸发结晶;蒸发操作除用到酒精灯、蒸发皿外,还要用玻璃棒搅拌;②设样品中Na2O2质量为x g、NaOH质量为y g,则x+y=m1,生成NaCl的质量为58.5×(![]() )=m2,解得:x=39×(
)=m2,解得:x=39×(![]() );在转移溶液时,若溶液转移不完全,则测得NaCl的质量(m2)偏小,根据上述Na2O2质量的表达式可得,测得的Na2O2的质量(x)会偏小,所以测得的Na2O2质量分数偏小。
);在转移溶液时,若溶液转移不完全,则测得NaCl的质量(m2)偏小,根据上述Na2O2质量的表达式可得,测得的Na2O2的质量(x)会偏小,所以测得的Na2O2质量分数偏小。

【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆